
题目列表(包括答案和解析)
(1)硅酸盐工业就是________,其中水泥的生产原料是________,产品的主要成分是________,加入石膏的目的是________.钢化玻璃的成分是________生产中发生化学反应的方程式是________,________.
(2)自然界氮的固定是________,________,工业上制法得的50%的稀硝酸通过________方法变成浓硝酸.
(3)为了除去铝土矿中少量Fe2O3和SiO2等杂质制得纯净的,操作过程如下图:
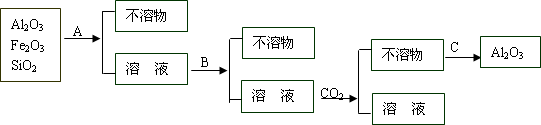
①、操作过程中的试剂或方法:A是________,B是________,C是________.
②、在溶液中加入B后发生反应的离子方程式为________,________,在溶液中通入过量CO2后发生反应的离子方程式为________.
③、如果A、B互换,则通CO2应改加________.

(1)写出滤液A中一种溶质与过量NaOH溶液反应而进入滤液B中的离子方程式:_____
____________________。
(2)在实验①中除去了铝土矿中的__________;在实验②中,除去了铝土矿中的__________;在实验③应加入的是__________,所发生反应的离子方程式为_______________________。
(3)若实验①中不过滤,对后面的操作将产生什么样的影响:________________________。
(4)Al2O3的熔点是2045 ℃,直接受热熔融后通电进行电解冶炼铝,消耗电能太多。工业上采取的措施是熔融冰晶石(Na3AlF6),再加入Al2O3,Al2O3熔融在冰晶石里,然后通电进行电解。试评价这样的措施的意义是什么。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com