酒后驾车已成为一个社会问题,2013年1月1日起执行的新交规对酒后驾车作出严厉的处罚规定.检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种.
(1)早期是利用检测试剂颜色变化定性判断BrAC,曾用如下反应检测BrAC:
3CH
3CH
2OH+2KMnO
4→3CH
3CHO+2MnO
2+2KOH+2H
2O
上述反应中发生还原反应的过程是
→
(2)受上述方法启发,后来用五氧化二碘的淀粉溶液检测BrAC,溶液变蓝,乙醇被氧化为乙醛.该反应的化学方程式为
.
(3)已知:①2CH
3OH(l)+3CO
2(g)+4H
2O(g)△H
1=-1275.6kJ?mol
-1②2CO(g)=2CO
2(g)△H
2=-566.0kJ?mol
-1③H
20(g)=H
2O(l)△H
3=-44.0kJ?mol
-1写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
.
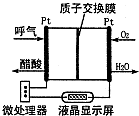
(4)如图是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应式为
,正极反应式为
.
(5)将0.2mol CO
2气体通入150mL、2mol?L
-1的NaOH溶液中,完全反应后所得溶液中各离子浓度由大到小的顺序是
.