
题目列表(包括答案和解析)
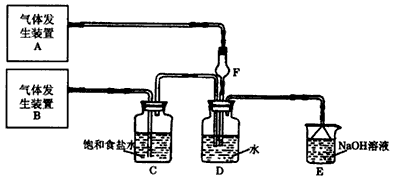
 某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现在足量的稀氯化亚铁溶液中加入1~2滴溴水,振荡后溶液呈黄色.
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现在足量的稀氯化亚铁溶液中加入1~2滴溴水,振荡后溶液呈黄色.| 编号 | 选用试剂 | 实验现象 |
| 方案1 | ||
| 方案2 |

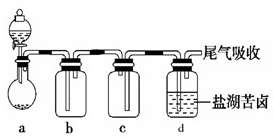
Ⅰ.溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色。某同学将稀溴水和稀FeCl2溶液混合,所得溶液显黄色。为探究溴水和FeCl2溶液混合能否发生反应,该同学设计了以下实验方案:
| 操作 | 实验现象 | 实验结论 | |
| 方案1 | 取少量混合溶液,加入NaOH溶液,振荡 | 得到红褐色沉淀 | 发生了化学反应 |
| 方案2 | 取少量混合溶液,加入四氯化碳溶液,振荡 | 有机层呈橙黄色 | 未发生化学反应 |
| 方案3 | 取少量混合溶液,加入淀粉碘化钾溶液,振荡 | 溶液变蓝色 | 未发生化学反应 |
请回答下列问题:
(1)方案2的结论不合理,其理由是
(2)方案3的结论明显不合理,可能发生反应的离子方程式
(3)请另外设计一个简单的实验方案(包括“操作”“现象”“结论”),判断溴水和FeCl2溶液是否反应。
。
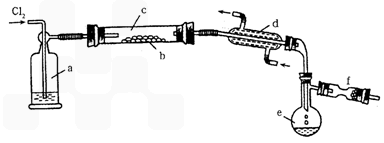
 Ⅱ.S2Cl2是一种易挥发的液体(熔点:-76℃,沸点:138℃),且易与水发生水解反应,可能生成H2S、SO2、H2SO3、H2SO4等物质。它是橡胶硫化剂。在熔融的硫中通以氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。
Ⅱ.S2Cl2是一种易挥发的液体(熔点:-76℃,沸点:138℃),且易与水发生水解反应,可能生成H2S、SO2、H2SO3、H2SO4等物质。它是橡胶硫化剂。在熔融的硫中通以氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。
(1)装置a中应放试剂为__________;装置d的名称是_________,它的作用是_________。
(2)该实验的操作顺序应为__________(用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(3)将S2Cl2的水解气体产物通入氯水中,若观察到_________的现象,则可证明水解产物中有硫化氢生成。
(12分)
2010年4月14日7时49分在青海省玉树地区发生7.1级地震,造成了重大的人员伤亡和财产损失。为了保证震区的卫生环境,常使用漂白液和漂白粉对环境和饮用水进行杀菌、消毒,以抑制大规模传染病爆发。
回答下列问题:
(1)漂白液的有效成分是(填化学式) ;
(2)某研究性学习小组对漂白液进行了如下实验探究:取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,可以证明漂白液具有的性质 (填序号)。
| A.酸性 | B.碱性 | C.强氧化性 | D.还原性 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com