
题目列表(包括答案和解析)
.(12分)由等物质的量的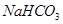 和
和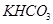 组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
(1)该混合物中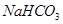 与
与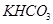 的质量分别为 和 。
的质量分别为 和 。
(2)若碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为  。
。
(3)如果盐酸过量,生成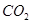 的体积为 L。
的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成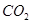 的体积,还需要知道 。
的体积,还需要知道 。
(5)若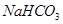 和
和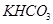 不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成
不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成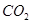 的物质的量(用n表示)的范围是 。
的物质的量(用n表示)的范围是 。
.(12分)由等物质的量的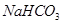 和
和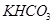 组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
组成的混合物18.400 g,与100 mL盐酸反应。(题中涉及的气体体积均为标准状况下,填空时可以用带字母的式子表示。)
(1)该混合物中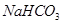 与
与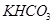 的质量分别为 和 。
的质量分别为 和 。
(2)若碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为 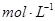 。
。
(3)如果盐酸过量,生成 的体积为 L。
的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成 的体积,还需要知道 。
的体积,还需要知道 。
(5)若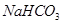 和
和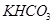 不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成
不是以等物质的量混合,则18.4 g固体混合物与足量的盐酸完全反应时生成 的物质的量(用n表示)的范围是
。
的物质的量(用n表示)的范围是
。
题目
(12分)实验室要用NaCl固体配制100mL 0.4mol·L-1的NaCl溶液,回答下列各题:
(1)实验中需要用到的仪器有:托盘天平、烧杯、玻璃棒、量筒、药匙,还缺少的玻璃仪器有___________________________;
(2)人们常将配制过程简述为以下各步骤:
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移
其正确的操作顺序应是______、 、A、G、C、G 、 (填各步骤序号);
(3)通过计算可得出可用托盘天平称取NaCl固体______________克;
(4)下列操作对所配溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)。
①摇匀后发现液面低于刻度线再加水:________________
②容量瓶中原有少量蒸馏水:________________
③定容时俯视观察液面:________________
(5分)钛(Ti )被称
为继铁、铝之后的第三金属。如下图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染。
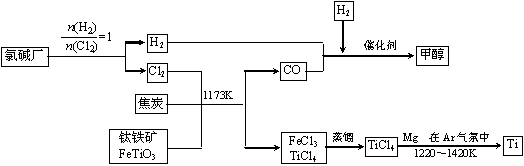
在上述产业链中,合成96 t甲醇理论上需额外补充H2 t (不考虑生产过程中物质的任何损失,要写出计算过程)。
选做题(本题分A、B两题,考生只要选择其中一题作答。若两题都作答,则以A题得分计入总分。本题共12分)
(13分)按要求完成下列各小题。
(1)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g) CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
|
化学键 |
C-C |
C-H |
H-H |
C-O |
C=O |
H-O |
|
键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
750 |
463 |
计算反应上述反应的焓变△H=_______________________
写出上述反应的平衡常数表达式K=__________________,若升高温度,则平衡常数K________(填“增大”或“减小”或“不变”)。该反应的△S______0(填“>”或“<”或“=”),在 _________(填“较高”或“较低”)温度下有利于该反应自发进行。
(2)在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为________________。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34。)
(3)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb= 。
(4)在25℃时,将cmol·L-1的醋酸溶液与0.02mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com