
题目列表(包括答案和解析)
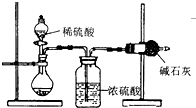 测定样品中成分含量的实验一般应重复二至三次.为了测定某NaOH固体中混有的Na2CO3的质量分数,某同学分别设计了三种实验方案:
测定样品中成分含量的实验一般应重复二至三次.为了测定某NaOH固体中混有的Na2CO3的质量分数,某同学分别设计了三种实验方案:| 106n |
| 197m |
| 106n |
| 197m |
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有澄清石灰水、______ ______的洗气瓶中,______. |
若澄清石灰水不变浑浊,木条复燃,则假设1成立; 若______,则假设2成立; 若澄清石灰水变浑浊,木条不复燃,则假设3成立. |
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有澄清石灰水、 的洗气瓶中, . | 若澄清石灰水不变浑浊,木条复燃,则假设1成立; 若 ,则假设2成立; 若澄清石灰水变浑浊,木条不复燃,则假设3成立. |
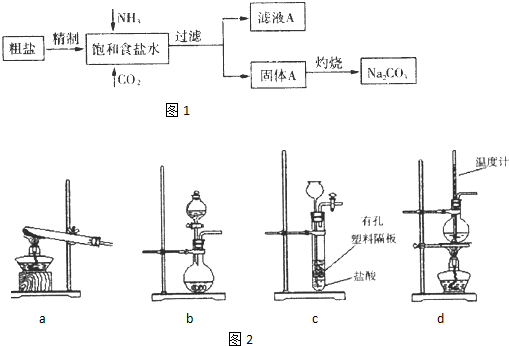
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有澄清石灰水、 8.0mol?L-1 8.0mol?L-1 NaOH溶液 NaOH溶液 的洗气瓶中,并将带火星的木条放在最后一个洗气瓶的出口处 并将带火星的木条放在最后一个洗气瓶的出口处 . |
若澄清石灰水不变浑浊,木条复燃,则假设1成立; 若 澄清石灰水变浑浊,木条复燃 澄清石灰水变浑浊,木条复燃 ,则假设2成立;若澄清石灰水变浑浊,木条不复燃,则假设3成立. |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com