
题目列表(包括答案和解析)
 硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸.
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸.![]()
A.Z的非金属性比Y强
B.X的最高价氧化物的水化物是一种强酸
C.Y的简单阴离子的还原性比Z的简单阴离子的还原性强
D.由Z单质形成的晶体属于分子晶体
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
| c(H+) |
| c(HF) |
| c(OH-) |
| c(H+) |
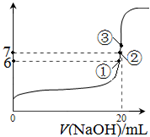

| 高温 |
| 高温 |
| c(SO42-) |
| c(CO32-) |
| 催化剂 |
| △ |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com