
题目列表(包括答案和解析)
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度/g/100g水 | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
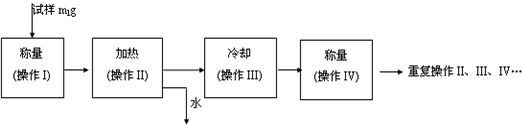
(15分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组拟用KMnO4溶液滴定的方法,测定该补血剂中铁元素的含量,进行了如下实验:
[查阅资料]
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量。反应的离子方程式是:Fe2++MnO4-+H+—— Fe3++Mn2++H2O(未配平)
[准备实验用品]
①仪器:a.电子天平,b.滴定管,c.100mL量筒,d.烧杯,e.漏斗,f.250mL容量瓶,g.锥形瓶,h.玻璃棒,i.药匙,j.烧瓶,k.铁架台(带滴定管夹),l.胶头滴管。
②试剂:a.硫酸亚铁补血剂药片,b.高锰酸钾晶体,c.酚酞溶液,d.KSCN溶液,
e.稀硫酸,f.稀盐酸,g.蒸馏水。
[实验步骤]
①称取0.474 g KMnO4晶体,配成250.00 mL水溶液;
②取5片除去糖衣(非还原糖)后的硫酸亚铁补血剂药片(1.500 g),研细后加稀硫酸溶解,配成100.00 mL水溶液。
③用酸式滴定管取待测“补血剂”溶液20.00mL于某容器中。
④盛装标准KMnO4溶液,静置后,读取数据,记录为KMnO4标准溶液体积的初读数。
⑤滴定,并记录KMnO4标准溶液的终读数。再重复滴定2次。
[实验记录]
| 滴定次数 实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
[交流与讨论]
(1)准备的实验用品中,不需要的仪器有(填序号) ▲ ;不需要的试剂有(填序号) ▲ 。
(2)本实验所用的KMnO4标准溶液的物质的量浓度为 ▲ 。
(3)课外小组里有位同学设计了下列四种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,认为最合理的是 ▲ (填字母序号)。
(4)判断滴定终点的依据是 ▲ 。
(5)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的补血剂中铁元素的含量会 ▲ (偏大、偏小、无影响)。
(6)根据实验数据,计算该补血剂中铁元素的含量 ▲ 。
(12分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组拟用KMnO4溶液滴定的方法,测定该补血剂中铁元素的含量,进行了如下实验:
[查阅资料]
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量。反应的离子方程式是:Fe2++MnO4-+H+—— Fe3++Mn2++H2O(未配平)
[准备实验用品]
①仪器:a.电子天平,b.滴定管,c.100mL量筒,d.烧杯,e.漏斗,f.250mL容量瓶,g.锥形瓶,h.玻璃棒,i.药匙,j.烧瓶,k.铁架台(带滴定管夹),l.胶头滴管。
②试剂:a.硫酸亚铁补血剂药片,b.高锰酸钾晶体,c.酚酞溶液,d.KSCN溶液,
e.稀硫酸,f.稀盐酸,g.蒸馏水。
[实验步骤]
①称取0.474 g KMnO4晶体,配成250.00 mL水溶液;
②取5片除去糖衣(非还原糖)后的硫酸亚铁补血剂药片(1.500 g),研细后加稀硫酸溶解,配成100.00 mL水溶液。
③用酸式滴定管取待测“补血剂”溶液20.00mL于某容器中。
④盛装标准KMnO4溶液,静置后,读取数据,记录为KMnO4标准溶液体积的初读数。
⑤滴定,并记录KMnO4标准溶液的终读数。再重复滴定2次。
[实验记录]
| 滴定次数 实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |

(15分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组拟用KMnO4溶液滴定的方法,测定该补血剂中铁元素的含量,进行了如下实验:
[查阅资料]
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量。反应的离子方程式是:Fe2++MnO4-+H+—— Fe3++Mn2++H2O(未配平)
[准备实验用品]
①仪器:a.电子天平,b.滴定管,c.100mL量筒,d.烧杯,e.漏斗,f.250mL容量瓶,g.锥形瓶,h.玻璃棒,i.药匙,j.烧瓶,k.铁架台(带滴定管夹),l.胶头滴管。
②试剂:a.硫酸亚铁补血剂药片,b.高锰酸钾晶体,c.酚酞溶液,d.KSCN溶液,
e.稀硫酸,f.稀盐酸,g.蒸馏水。
[实验步骤]
①称取0.474 g KMnO4晶体,配成250.00 mL水溶液;
②取5片除去糖衣(非还原糖)后的硫酸亚铁补血剂药片(1.500 g),研细后加稀硫酸溶解,配成100.00 mL水溶液。
③用酸式滴定管取待测“补血剂”溶液20.00mL于某容器中。
④盛装标准KMnO4溶液,静置后,读取数据,记录为KMnO4标准溶液体积的初读数。
⑤滴定,并记录KMnO4标准溶液的终读数。再重复滴定2次。
[实验记录]
| 滴定次数 实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 0.00 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 15.85 | 15.22 | 14.98 |
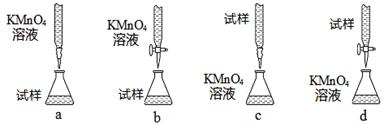
(12分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组拟用KMnO4溶液滴定的方法,测定该补血剂中铁元素的含量,进行了如下实验:
[查阅资料]
在酸性条件下,用KMnO4标准溶液进行氧化还原滴定,可以测定Fe2+的含量。反应的离子方程式是:Fe2++MnO4-+H+ —— Fe3++Mn2++H2O(未配平)
[准备实验用品]
①仪器:a.电子天平,b.滴定管,c.100mL量筒,d.烧杯,e.漏斗,f.250mL容量瓶,g.锥形瓶,h.玻璃棒,i.药匙,j.烧瓶,k.铁架台(带滴定管夹),l.胶头滴管。
②试剂:a.硫酸亚铁补血剂药片,b.高锰酸钾晶体,c.酚酞溶液,d.KSCN溶液,
e.稀硫酸,f.稀盐酸,g.蒸馏水。
[实验步骤]
①称取0.474 g KMnO4晶体,配成250.00 mL水溶液;
②取5片除去糖衣(非还原糖)后的硫酸亚铁补血剂药片(1.500 g),研细后加稀硫酸溶解,配成100.00 mL水溶液。
③用酸式滴定管取待测“补血剂”溶液20.00mL于某容器中。
④盛装标准KMnO4溶液,静置后,读取数据,记录为KMnO4标准溶液体积的初读数。
⑤滴定,并记录KMnO4标准溶液的终读数。再重复滴定2次。
[实验记录]
|
滴定次数 实验数据 |
1 |
2 |
3 |
|
V(样品)/mL |
20.00 |
20.00 |
20.00 |
|
V(KMnO4)/mL(初读数) |
0.00 |
0.20 |
0.00 |
|
V(KMnO4)/mL(终读数) |
15.85 |
15.22 |
14.98 |
[交流与讨论]
(1)准备的实验用品中,不需要的仪器有(填序号) ;不需要的试剂有(填序号) 。
(2)本实验所用的KMnO4标准溶液的物质的量浓度为 。
(3)课外小组里有位同学设计了下列四种滴定方式(夹持部分略去),引起了同学们的讨论,最后取得共识,认为最合理的是 (填字母序号)。

(4)判断滴定终点的依据是 。
(5)根据实验数据,计算该补血剂中铁元素的含量 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com