
题目列表(包括答案和解析)
(1)某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相
对密度为13,在标准状况下,将56.0L混合气体通入足量溴水,溴水质量增重35.0g,则
烷烃结构式为 ______ 。混合气体中烷和烯的物质的量之比为_______________。
(2)某有机物A的相对分子质量为62。为进一步测定A的化学式,现取6.2 g A完全燃烧,
得到二氧化碳和水蒸气。将产物先后通过足量的浓硫酸和碱石灰,两者分别增重5.4 g和
8.8 g (假设每步反应均完全)。该有机物的实验式是_____ ,分子式是____ ____。
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:


氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)写出制备 NH4Cl的化学方程式: 。
(2)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
 (3)实验过程中趁热过滤的目的是 。趁热过滤可采用抽滤装置,抽滤装置如图1所示,该装置中的错误之处是 ;若用普通的漏斗,贴上滤纸后,接上抽滤瓶进行吸滤则不行,因为 。
(3)实验过程中趁热过滤的目的是 。趁热过滤可采用抽滤装置,抽滤装置如图1所示,该装置中的错误之处是 ;若用普通的漏斗,贴上滤纸后,接上抽滤瓶进行吸滤则不行,因为 。
![]() (布氏漏斗的使用:一般先在圆筒底面垫上滤纸,将布氏漏斗插进抽滤瓶并将接口密封。抽滤瓶的侧口连抽气系统。然后将欲分离的固体、液体混合物倒进上方,液体成分在负压力作用下被抽进抽滤瓶中,固体留在上方。)
(布氏漏斗的使用:一般先在圆筒底面垫上滤纸,将布氏漏斗插进抽滤瓶并将接口密封。抽滤瓶的侧口连抽气系统。然后将欲分离的固体、液体混合物倒进上方,液体成分在负压力作用下被抽进抽滤瓶中,固体留在上方。)

图1 图2
(4)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体____。
A.缓慢冷却溶液 B.溶液浓度较高 C.溶质溶解度较小 D.缓慢蒸发溶剂
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 ___。某研究性学习小组为测定该NH4Cl产品中氮的含量,设计了如图2装置,并进行了讨论。
甲同学:根据此实验测得的数据,计算的NH4Cl产品的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:__ ____。
乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液一定要足量并充分加热,原因是 。
用改进后的实验装置重新进行实验,称取13.5gNH4Cl产品,测得实验后B装置增重3.4g。则该化肥含氮量为 。
(1)某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将56.0L混合气体通入足量溴水,溴水质量增重35.0g,则烷烃结构式为 ______ 。混合气体中烷和烯的物质的量之比为_______________。
(2)某有机物A的相对分子质量为62。为进一步测定A的化学式,现取6.2 g A完全燃烧,得到二氧化碳和水蒸气。将产物先后通过足量的浓硫酸和碱石灰,两者分别增重5.4 g和8.8 g (假设每步反应均完全)。该有机物的实验式是_____ ,分子式是____ ____。
无色晶体硫酸锌,俗称皓矾,在医疗上用作收敛剂,工业上作防腐剂、制造白色颜料(锌钡白)等。某实验小组欲用制氢废液制备硫酸锌晶体,进行了以下实验:
(1)取50mL制氢废液,过滤。除去不溶性杂质后,用ZnO调节滤液使pH约等于2,加热、蒸发、浓缩制得较高温度下的硫酸锌饱和溶液,冷却结晶,得到粗制的硫酸锌晶体。
①加入少量氧化锌调节滤液使pH≈2目的是 ;
②加热蒸发、浓缩溶液时,应加热到 时,停止加热。
(2)粗晶体在烧杯中用适量蒸馏水溶解,滴加1~2滴稀硫酸,用沸水浴加热至晶体全部溶解。停止加热,让其自然冷却、结晶。抽滤(装置如图所示)。将所得晶体用少量无水乙醇洗涤1-2次,得到较纯的硫酸锌晶体。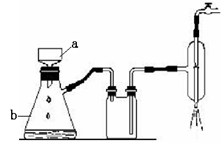
①写出下列仪器的名称。a ;b
②抽滤跟普通过滤相比,除了得到沉淀较干燥外,还有一个优点是 。
③用少量无水乙醇洗涤晶体的目的是 。
(3)在制取氢气时,如果锌粒中混有少量的铁、铜杂质,对硫酸锌的质量 (填“有”、“无”)影响,原因是 。
(1)某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将56.0L混合气体通入足量溴水,溴水质量增重35.0g,则烷烃结构式为 ______ 。混合气体中烷和烯的物质的量之比为_______________。
(2)某有机物A的相对分子质量为62。为进一步测定A的化学式,现取6.2 g A完全燃烧,得到二氧化碳和水蒸气。将产物先后通过足量的浓硫酸和碱石灰,两者分别增重5.4 g和8.8 g (假设每步反应均完全)。该有机物的实验式是_____ ,分子式是____ ____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com