
题目列表(包括答案和解析)


(14分) “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000 kJ·m-3的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:
C(s)+O2(g)=CO2(g) ΔH1=—393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(g) ΔH2=—483.6 kJ·mol-1 ②
C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1 ③
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
(2)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体在正极反应,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为 。
(3)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则该温度下的平衡常数K= ;A、B两点时容器中物质的物质的量之比为n(A)总:n(B)总= 。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是 。
A 降温 B 加压 C 使用催化剂 D 将甲醇从混合体系中分离出来
(15分)
我国规定:室内甲醛含量不得超过0.0 8mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛(HCHO)的含量。
【查阅资料】KMnO4 ( H+)溶液为强氧化剂,可氧化甲醛和草酸。
4MnO4―+5HCHO+H+=4Mn2++5CO2↑+11H2O
2MnO4―+5H2C2O4+6H+=2Mn2++10CO2 ↑+8H2O
【实验一】
按如图所示装置进行采样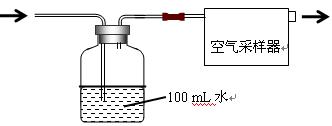
(1)由图可知甲醛的物理性质为
(2)空气中甲醛采样吸收装置中用到的玻璃仪器为:玻璃导管、
(3)为了使通过吸收装置的甲醛尽可能被吸收液吸收,可采取的措施是:(只写出一种即可) 。
设置空气采集器为恒定流量0.5 L/min,采集20min。
【实验二】
量取10.00 mL 的甲醛吸收液转移到锥形瓶中,量取12.00 mL 1.00×10-3 mol·L-1 KMnO4溶液于锥形瓶中,并滴入几滴稀H2SO4备用。
(4)用1.00×10-3 mol·L-1标准草酸溶液进行滴定,当
时,达到滴定终点。
(5)记录滴定所消耗的草酸溶液的体积。重复实验2次,消耗草酸溶液的体积分别为10.90 mL、10.02 mL、9.98 mL。计算该居室内空气中甲醛的浓度为 mg·m-3。
(6)若滴定过程中,发现滴定管下端开始有气泡,滴定后气泡消失,则测定结果将
(填“偏大”、“无影响”、“偏小”)
【实验三】
环境监测站工作人员采样后,将5.00 mL 的甲醛吸收液注入比色瓶中,再向比色瓶中注入显色试剂0.5 mL,盖紧瓶塞,摇匀,静置显色。当室内环境温度不同时,记录显色时间见下表。
| 环境温度/℃ | 5 | 10 | 15 | 20 | 25 | 30 | 35 |
| 显色时间/min | 45 | 30 | 15 | 13 | 10 | 7 | 5 |
(6分)工业上用电解饱和食盐水的方法生产氯气和烧碱。
(1)食盐溶于水发生电离,其电离方程式为____________________________________。
(2)2004年4月15日,某化工厂发生氯气泄漏事件,工作人员喷射 溶液形成液幕,包围并吸收泄漏的氯气,其反应原理为__________________(用离子方程式表示)。
溶液形成液幕,包围并吸收泄漏的氯气,其反应原理为__________________(用离子方程式表示)。
(3)事件过后,附近居民向记者反映当时晾在外面的衣服褪色了,其原因是_________
___________________________(结合化学方程式解释)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com