我国硫酸工业SO
2年排放量约10万吨,硫酸工业的尾气必须进行处理.
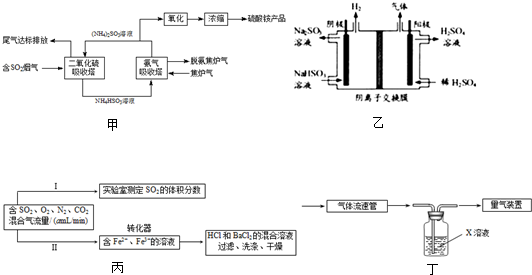
(1)某工厂采用氨-硫酸铵治理含硫烟气和同时吸收焦炉气中的氨,其工艺流程图如甲:
①从环境保护的角度看,采用上述工艺可防止
酸雨的产生、水体氮富营养化
酸雨的产生、水体氮富营养化
;设计一个简单的实验方案,检验尾气中是否含有氨气:
将湿润的红色石蕊试纸伸入尾气样品中,观察试纸是否变红
将湿润的红色石蕊试纸伸入尾气样品中,观察试纸是否变红
.
②氨气吸收塔中发生反应的离子方程式为
HSO3-+NH3?H2O=SO32-+NH4++H2O(或:HSO3-+NH3=SO32-+NH4+)
HSO3-+NH3?H2O=SO32-+NH4++H2O(或:HSO3-+NH3=SO32-+NH4+)
.
(2)用Na
2SO
3溶液吸收SO
2,再用惰性电极电解吸收液将其转化为H
2SO
4的装置如图乙所示.阳极电极反应有两个,其电极反应式分别为:2H
2O-4e
-=O
2+4H
+和
HSO3--2e-+H2O=3H++SO42-
HSO3--2e-+H2O=3H++SO42-
.
(3)利用Fe
3+的氧化性,将SO
2氧化成SO
42-而实现SO
2的回收利用.为测定转化器中SO
2氧化成SO
42-的转化率,设计如图丙两个实验.
①实验Ⅰ可采用如图丁装置模拟测定烟气中SO
2的体积分数.X溶液既要能吸收又要能指示反应终点,则X溶液最好选用
碘的淀粉溶液(或酸性KMnO4溶液)
碘的淀粉溶液(或酸性KMnO4溶液)
.
实验Ⅰ还可采用下列方案:取280mL(标准状况)气体样品与足量Fe
2(SO
4)
3溶液完全反应后,用浓度为0.020mol/L的K
2Cr
2O
7溶液滴定反应生成的Fe
2+,至终点消耗K
2Cr
2O
7溶液25.00mL.尾气中SO
2的体积分数为
12.00%
12.00%
.
已知:Cr
2O
72-+Fe
2++H
+→Cr
3++Fe
3++H
2O(未配平).
②实验Ⅱ测定转化了的SO
2,转化器中反应的离子方程式为
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
;假设测定在标准状况下进行,且已知混合气体流速,该实验中还需测定的数据有:实验时间、
BaSO4的质量
BaSO4的质量
.




 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-