甲醇(CH3OH)作为新型汽车动力燃料,以下是甲醇在工业上的制备和生活中的应用。
请填空:
(1)在压强为0.1MPa条件下,反应室2(容积为VL)中a mol CO与2a mol H
2在催化剂作用下反应生成甲醇:CO (g) +2H
2(g)

CH
3OH (g),CO的平衡转化率与温度、压强的关系如图所示,则:
①一定条件下的密闭容器中,该反应到达平衡,要提高CO的转化率可以采取的措施是_______ (填字母代号)
A.高温高压 B.加入催化剂 C.增加CO的浓度 D.增大氢气的浓度 E分离出甲醇
②在压强P1、100℃时,CH
3OH(g)

CO(g) + 2H
2(g)反应的平衡常数为________(用含a、V的代数式表示)
③将一定量的NO
2与SO
2置于绝热恒容密闭容器中发生NO
2(g)+SO
2(g)

SO
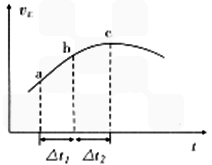
3(g)+NO(g)上述反应,正反应速率随时间变化的趋势如图所示。由图可知下列说法正确的是__________(填字母)。
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.△t1=△t2时,SO2的消耗量:a~b段大于b~c段
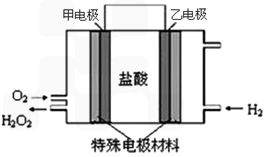
(2)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以H2和O2为原料制取过氧化氢的新工艺。原理如图所示:请写出甲电极的电极反应式:________________________。
(3)若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52 kJ的能量,则等质量的甲醇燃料电池利理论上可提供________mol电子的电量。(已知甲醇的燃烧热为725.76 kJ/mol)
(4)已知在常温常压下:
①2CH3OH (l)+3O2(g) == 2CO2(g)+4H2O (g) ΔH1=-1275.6 kJ/mol
②2CO (g)+O2(g) == 2CO2(g) ΔH2=-566.0 kJ/mol
③H2O (g) = H2O (l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____________________。

 CH3OH (g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH (g),CO的平衡转化率与温度、压强的关系如图所示,则: 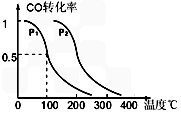
 CO(g) + 2H2(g)反应的平衡常数为________(用含a、V的代数式表示)
CO(g) + 2H2(g)反应的平衡常数为________(用含a、V的代数式表示)  SO3(g)+NO(g)上述反应,正反应速率随时间变化的趋势如图所示。由图可知下列说法正确的是__________(填字母)。
SO3(g)+NO(g)上述反应,正反应速率随时间变化的趋势如图所示。由图可知下列说法正确的是__________(填字母)。