
题目列表(包括答案和解析)
一包质量为23.24g的粉末,它是由NaCl、CuSO4、Na2O2、K2CO3、(NH4)2SO4、Na2SO4、KNO3等7种物质中的某几种混合而成。为测定其组成,进行以下实验:
(1)将粉末全部投入到足量蒸馏水中,得无色溶液与气体,加热使反应完全,共收集到气体3.36L(标准状况);
(2)将所得溶液分成两等份,一份加入酚酞溶液呈红色,用浓度为4mol·L–1的盐酸中和,用去该盐酸12.5mL;
(3)将另一份用稀硝酸酸化,无气体产生,再加过量的Ba(NO3)2溶液,得白色沉淀,质量为12.815g,滤液中加入AgNO3溶液,无可见现象;
(4)所得3.36L气体通过浓硫酸,气体体积明显减少,再通过碱石灰,气体体积不变。
试根据以上实验现象判断、计算、得出结论。(将结论填入下边,有几种物质填几空)
| 粉末组成物质分别是 |
|
|
|
|
|
|
| 质量为(g) |
|
|
|
|
|
|
一包质量为23.24g的粉末,它是由NaCl、CuSO4、Na2O2、K2CO3、(NH4)2SO4、Na2SO4、KNO3等7种物质中的某几种混合而成。为测定其组成,进行以下实验:
(1)将粉末全部投入到足量蒸馏水中,得无色溶液与气体,加热使反应完全,共收集到气体3.36L(标准状况);
(2)将所得溶液分成两等份,一份加入酚酞溶液呈红色,用浓度为4mol·L–1的盐酸中和,用去该盐酸12.5mL;
(3)将另一份用稀硝酸酸化,无气体产生,再加过量的Ba(NO3)2溶液,得白色沉淀,质量为12.815g,滤液中加入AgNO3溶液,无可见现象;
(4)所得3.36L气体通过浓硫酸,气体体积明显减少,再通过碱石灰,气体体积不变。
试根据以上实验现象判断、计算、得出结论。(将结论填入下边,有几种物质填几空)
| 粉末组成物质分别是 | | | | | | |
| 质量为(g) | | | | | | |
一包质量为23.24g的粉末,它是由NaCl、CuSO4、Na2O2、K2CO3、(NH4)2SO4、Na2SO4、KNO3等7种物质中的某几种混合而成。为测定其组成,进行以下实验:
(1)将粉末全部投入到足量蒸馏水中,得无色溶液与气体,加热使反应完全,共收集到气体3.36L(标准状况);
(2)将所得溶液分成两等份,一份加入酚酞溶液呈红色,用浓度为4mol·L–1的盐酸中和,用去该盐酸12.5mL;
(3)将另一份用稀硝酸酸化,无气体产生,再加过量的Ba(NO3)2溶液,得白色沉淀,质量为12.815g,滤液中加入AgNO3溶液,无可见现象;
(4)所得3.36L气体通过浓硫酸,气体体积明显减少,再通过碱石灰,气体体积不变。
试根据以上实验现象判断、计算、得出结论。(将结论填入下边,有几种物质填几空)
|
粉末组成物质分别是 |
|
|
|
|
|
|
|
质量为(g) |
|
|
|
|
|
|
(分)一包质量为23.24g的粉末,它是由NaCl、CuSO4、Na2O2、K2CO3、(NH4)2SO4、Na2SO4、KNO3等7种物质中的某几种混合而成。为测定其组成,进行以下实验:
(1)将粉末全部投入到足量蒸馏水中,得无色溶液与气体,加热使反应完全,共收集到气体3.36L(标准状况);
(2)将所得溶液分成两等份,一份加入酚酞溶液呈红色,用浓度为4mol·L–1的盐酸中和,用去该盐酸12.5mL;
(3)将另一份用稀硝酸酸化,无气体产生,再加过量的Ba(NO3)2溶液,得白色沉淀,质量为12.815g,滤液中加入AgNO3溶液,无可见现象;
(4)所得3.36L气体通过浓硫酸,气体体积明显减少,再通过碱石灰,气体体积不变。
试根据以上实验现象判断、计算、得出结论。(将结论填入下边,有几种物质填几空)
| 粉末组成物质分别是 | ||||||
| 质量为(g) |
植物生长需要营养,实验室现有一包由氯化铵和硫酸铵混合而成的白色粉末,课外小组的同学按下图设计进行实验,测定这种混合物中各组分的含量,以便给植物施用。
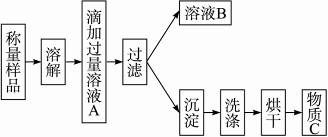
(1)溶液A中溶质的化学式________。
(2)他将样品放入托盘天平的右盘中,样品质量记录游码为0.4 g,左边的托盘里的砝码为16 g,则样品质量是________g。
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是________。
(4)怎样证明滴加溶液A已经过量,简述操作方法________________。
(5)若物质C的质量为23.3 g,那么原混合物中氯化铵的质量分数为________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com