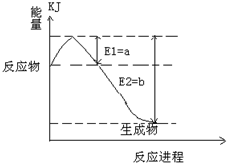
(2012?虹口区二模)往硫酸与硝酸的混合溶液中投入一块未除氧化膜的铝箔,微热使之完全反应,产生2.24L (已折算为标准状况)NO与H
2的混合气体,且该混合气体的平均摩尔质量为13.20g/mol.
(1)若将混合气体与一定量的氧气在一定条件下充分反应后,恰好全部转化为硝酸溶液.
①混合气体中NO的体积分数为
0.4
0.4
.②所用氧气在标准状况下的体积为
1.344
1.344
L.
(2)向铝箔与混酸反应后的溶液中趁热加入一定质量的(NH
4)
2SO
4,冷却后全部溶液正好转化为40.77g铝铵矾晶体[化学式:NH
4Al(SO
4)
2?12H
2O,式量:453].
①原铝箔中金属铝的质量为
2.16
2.16
,氧化膜的物质的量为
0.005mol
0.005mol
.
②计算原混酸中硫酸的质量分数(精确到0.001,写出计算过程)
0.395
0.395
.
(3)另取铝铵矾溶于水后按一定比例加到碳酸氢铵溶液中,既有气体又有沉淀生成.取27.8g沉淀,平均分为两份.
第一份加强热使其完全分解,最终得到5.1g氧化铝粉末.
第二份加入足量的盐酸,固体完全溶解,生成0.1mol气体.往所得溶液中加入足量的NaOH并微热,又生成0.1mol气体.
通过计算推测沉淀的化学式并写出生成该沉淀的化学方程式
NH4Al(OH)2CO3,NH4Al(SO4)2+4NH4HCO3=NH4Al(OH)2CO3↓+2(NH4)2SO4+3CO2↑+H2O
NH4Al(OH)2CO3,NH4Al(SO4)2+4NH4HCO3=NH4Al(OH)2CO3↓+2(NH4)2SO4+3CO2↑+H2O
.


 合物的反应有重要意义.
合物的反应有重要意义.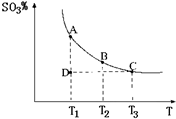 (2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(2011?松江区模拟)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义. 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题: 2SO3(g)是
2SO3(g)是