
题目列表(包括答案和解析)
(每空2分,共22分)
I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L · s)]与反应时间t(s)的关系如图所示。回答如下问题:

(1)该反应的化学方程式:
(2)0→t2时间段内反应速率增大的原因是: ,
(3)t2→t时间段内反应速率减小的原因是: ,
(4)图中阴影部分“面积”表示t1→t3时间里 。
A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42-物质的量浓度 D.MnO4-物质的量浓度的减小
II. 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验。请回答相关问题:
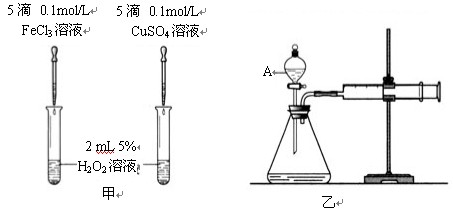
(1)定性分析:如上图甲可观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如上图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的数据是
(3)加入0.01mol MnO2粉末于60mL H2O2溶液中,在标准状况下放出气体体积和时间的关系如图所示。设放出气体的总体积为V mL。
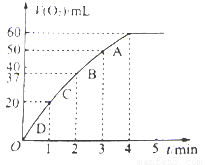
①放出V/3 mL气体时所需时间为 min。
② 该H2O2溶液的浓度为
③A、B、C、D各点反应速率快慢的顺序为 > > >
(共22分)
Ⅰ.(4分)下列实验操作中,合理的是
A.实验室制乙烯时,在酒精和浓硫酸的混合液中,放入几片碎瓷片,加热混合物,使液体温度迅速升到170℃
B.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置,待液体分层后,滴加硝酸银溶液
C.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入无水乙醇中,完成乙醇氧化为乙醛的实验
D.苯酚中滴加少量稀溴水,可用来定量检验苯酚
E.工业酒精制取无水酒精时,先加生石灰然后蒸馏,蒸馏必须将温度计的水银球插入反应液中,测定反应液温度
Ⅱ.(10分)实验室用下图所示装置制备溴苯,并验证该反应是取代反应。

(1) 关闭F活塞,打开C活塞,在装有少量苯的三颈瓶中由A口加入少量溴,再加入少量铁屑,塞住A口,则三颈瓶中发生反应的化学方程式为: 。
(2) D试管内装的是 ,其作用是 。
(3) E试管内装的是 ,E试管内出现的现象为 。
(4) 待三口烧瓶中的反应即将结束时(此时气体明显减少),打开F活塞,关闭C活塞,可以看到的现象是 。
(5) 上一步得到粗溴苯后,要用如下操作精制:
a蒸馏; b水洗; c用干燥剂干燥; d 10%NaOH溶液洗涤; e水洗
正确的操作顺序是
Ⅲ.(8分)用如右图所示装置进行实验,将A逐滴加入B中:

(1) 若B为Na2CO3粉末,C为C6H5ONa溶液,实验中观察到小试管内溶液由澄清变浑浊,则试管C中化学反应的离子方程式:________________ 。然后往烧杯中加入沸水,可观察到试管C中的现象: 。
(2) 若B是生石灰,观察到C溶液中先形成沉淀,然后沉淀溶解.当沉淀完全溶解,恰好变澄清时,关闭E.然后往小试管中加入少量乙醛溶液,再往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是 (填名称),C是 (填化学式),与乙醛的混合后,该溶液中反应的化学方程式: _____________。仪器D在此实验中的作用是 。
(每空2分,共22分)
I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L · s)]与反应时间t(s)的关系如图所示。回答如下问题:
(1)该反应的化学方程式:
(2)0→t2时间段内反应速率增大的原因是: ,
(3)t2→t时间段内反应速率减小的原因是: ,
(4)图中阴影部分“面积”表示t1→t3时间里 。
A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42-物质的量浓度 D.MnO4-物质的量浓度的减小
II. 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如下图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如上图甲可观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如上图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的数据是
(3)加入0.01mol MnO2粉末于60mL H2O2溶液中,在标准状况下放出气体体积和时间的关系如图所示。设放出气体的总体积为V mL。
①放出V/3 mL气体时所需时间为 min。
② 该H2O2溶液的浓度为
③A、B、C、D各点反应速率快慢的顺序为 > > >
(22分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)(3分)写出制取乙酸乙酯的化学反应方程式(有机物用结构简式表示):
(2)(3分)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的顺序是:先在试管中加入一定量的 ,然后边加边振荡试管将 加入试管,冷却后再加入 。

(3)(4分)浓硫酸的作用是:① ;② 。
(4)(3分)饱和碳酸钠溶液的主要作用是 。
(5)(2分)在实验中球形干燥管除起冷凝作用外,另一个重要作用是 。
(6)(2分)若要把制得的乙酸乙酯分离出来,应采用的实验操作叫 。
(7)(2分)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的 。
(8)(3分)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化。
(22分)在一固定容积的密闭容器中进行着如下反应:CO2(g) + H2(g) CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1) K的表达式为:________________________;
(2) 该反应的正反应为 _______反应(“吸热”或“放热”);
(3) 能判断该反应是否已经达到化学平衡状态的是: ________
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4) 在850℃时,可逆反应:CO2(g) + H2(g) CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2 O (mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
①前2min,用CO2表示该化学反应的速率是________________________________;
②在3-4min之间,反应处于_____________状态(填“平衡”或“非平衡”)。
③计算:3min—4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出计算过程(850℃时,K值从上表可查出;c3精确到小数点后面三位数)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com