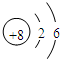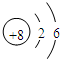有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B 元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质,C为原子核内有12个中子的二价金属,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,D的M层上7个电子.
(1)分别写出B、D的最高价氧化物的水化物的化学式
NaOH
NaOH
,
HClO4
HClO4
.
(2)写出单质A与氢气反应的化学方程式:
.
(3)比较D的气态氢化物与H
2S和HF的稳定性:
HF>HCl>H2S
HF>HCl>H2S
.
(4)C与D两元素最高价氧化物的水化物反应的离子方程式
Mg(OH)2+2H+=Mg2++2H2O
Mg(OH)2+2H+=Mg2++2H2O
.