
题目列表(包括答案和解析)
0.2 mol KMnO4在一定温度下加热生成a mol O2,将剩余的固体与足量浓盐酸混合加热又生成b mol Cl2,此时锰元素均以Mn2+的形式存在。若|a-b|=m,则m的值可能是( )
A.0.15 B.0.45 C.0.55 D.0.60


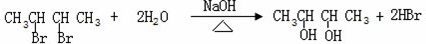
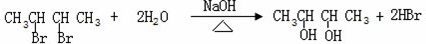
燃烧法是测定有机化合物化学式的一种重要方法.在一定温度下取0.1 mol某气态烃A在O2中完全燃烧,生成CO2和水蒸汽,放出热量Q kJ,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重7.2 g,碱石灰增重17.6 g.将烃A加入酸性KMnO4溶液或Br2的CCl4溶液,均能使它们褪色.
(1)写出烃A的分子式
(2)已知烃A分子结构高度对称且有两个甲基
①写出烃A使Br2的CCl4溶液褪色的化学方程式________
②烃A在一定条件下可以通过加聚反应合成一种塑料,则该反应的化学方程式是________
草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示。
|
| H2C2O4 | KHC2O4 | K2C2O4 |
| pH | 2.0 | 3.1 | 8.1 、 |
(1)在其它条件不变时,下列措施能使KHC2O4溶液中c(K+):c(HC2O4-)接近1:1的是_________(填字母)。
A.加入适量的H2C2O4 B.加入适量的KHC2O4
C.加入适量的Na2C2O4 D.升高溶液的温度
(2)取一定质量H2C2O4·2H2O和KHC2O4的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2S04溶液酸化后,用0.10 mol·L-lKMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
①完成离子方程式:5C2O42-+2MnO4-+16H+=10______+2Mn2++8H2O。
②原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为__________。
(3)某实验小组用如图所示的装置探究FeC2O4·2H2O在隔绝空气条件下受热分解的产物。当36.0g FeC2O4·2H2O充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量。(已知FeC2O4·2H2O的相对分子质量为180;设反应产生的气体被充分吸收)
草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示。
| | H2C2O4 | KHC2O4 | K2C2O4 |
| pH | 2.0 | 3.1 | 8.1 、 |
| A.加入适量的H2C2O4 | B.加入适量的KHC2O4 |
| C.加入适量的Na2C2O4 | D.升高溶液的温度 |
 mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2S04溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:
mol·L-l NaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-l H2S04溶液酸化后,用0.10 mol·L-l KMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题: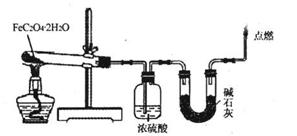
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com