
题目列表(包括答案和解析)
电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应式是:Zn+2OH――2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-。总反应式为:Ag2O+Zn=2Ag+ZnO,下列说法正确的是( )
A.Zn为正极,Ag2O为负极 B.Zn为负极,Ag2O为正极
C.原电池工作时,正极区溶液PH值减小 D.原电池工作时,负极区溶液PH值增大


电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该厂所用原料如下:FeCl3、Fe粉、Cl2 、HCl 。为了使FeCl3能循环使用,且回收较贵重的金属铜设计了如下操作流程
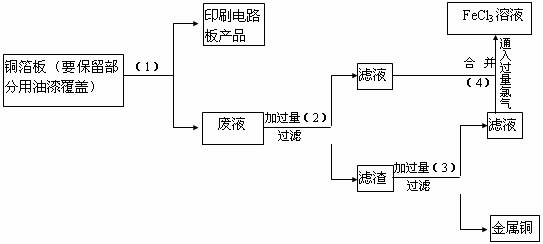
回答下列问题
(一).流程图中(1)加入的是
其反应的离子方程式为
(二).流程图(2)中是加入过量的铁粉,发生反应的离子方程式为
(三).滤渣里含 ;
加过量的(3)后发生反应的离子方程式为
流程图(4)滤液与氯气反应的离子方程式为
(四).制造印刷电路板的过程中实际消耗的原料是 、 、
电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用。按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。

(1)写出FeCl3溶液与铜箔发生反应的化学方程式:__________________________。
(2)检验废腐蚀液中含有Fe3+的实验操作是 。
(3)“过滤”用到的玻璃仪器有:普通漏斗、 。
(4)废液中加入过量①后,发生反应的离子方程式: 。
(5)上述流程中取废液200 mL,其中含CuCl2 1.5 mol·L—1、FeCl2 3.0mol·L—1、FeCl3 1.0 mol·L—1,若要将铜全部回收,需加入Fe粉的质量应不少于________g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于______mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com