
题目列表(包括答案和解析)
(9分)(1)已知:N N的键能是946 kJ/mol,H—H的键能为436 kJ/mol,N—H的键能为391 kJ/mol,请据此写出合成氨反应的热化学方程式
;
N的键能是946 kJ/mol,H—H的键能为436 kJ/mol,N—H的键能为391 kJ/mol,请据此写出合成氨反应的热化学方程式
;
该反应的熵变△S 0(填“>”、“<”或“=”)。
(2)将1 mol N2与3 mol H2混合置于容积为10 L的密闭容器中。
①温度为T1时,混合气体中氨的物质的量分数为25%,则N2的转化率为 。
②当温度由T1变化到T2 (T2 >T1)时(如图),平衡常数KA KB(填“>”、“<”或“=”)。
③温度在T1时,若起始时向10L密闭容器中加入N2 0.5 mol、H2 1.5 mol、NH3 1 mol。当反应达到平衡时,与起始时比较, (填化学式)的物质的量增加。
(9分)(1)1 mol气态钠离子和1 mol气态氯离子结合生成1 mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
①下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是____________。
A.Na+(g)+Cl-(g)―→NaCl(s);△Q
B.Na(s)+Cl2(g)―→NaCl(s);△Q1
C.Na(s)―→Na(g);△Q2
D.Na(g)-e-―→Na+(g);△Q3
E.Cl2(g)―→Cl(g);△Q4
F.Cl(g)+e-―→Cl-(g);△Q5
②写出△Q1与△Q、△Q2、△Q3、△Q4、△Q5之间的关系式________________________________________________________________________
(2)可逆反应:aA(g)+bB(g)  ??cC(g)+dD(g),取a mol A和b mol B置于V L密闭容器中,2
min后,测得容器中A的浓度为x mol·L-1,以物质C的浓度变化来表示这段时间内反应的平均速率应为__________ __。
??cC(g)+dD(g),取a mol A和b mol B置于V L密闭容器中,2
min后,测得容器中A的浓度为x mol·L-1,以物质C的浓度变化来表示这段时间内反应的平均速率应为__________ __。
(9分)(1)已知:NN的键能是946 kJ/mol,H—H的键能为436 kJ/mol,N—H的键能为391 kJ/mol,请据此写出合成氨反应的热化学方程式 ;
该反应的熵变△S 0(填“>”、“<”或“=”)。
(2)将1 mol N2与3 molH2混合置于容积为10 L的密闭容器中。
①温度为T1时,混合气体中氨的物质的量分数为25%,则N2的转化率为 。
②当温度由T1变化到T2(T2 >T1)时(如图),平衡常数KA KB(填“>”、“<”或“=”)。
③温度在T1时,若起始时向10L密闭容器中加入N2 0.5 mol、H2 1.5 mol、NH3 1 mol。当反应达到平衡时,与起始时比较, (填化学式)的物质的量增加。
(9分)
(1)写出下列物质的结构简式:2,3,3—三甲基戊烷 ;2,4-二氯甲苯的结构简式为 ;反-2-戊烯的结构简式为 ;
(2)某链状有机物中含有n个—CH2—,m个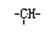 和a 个—CH3,其余为—OH,则—OH 的个数为
和a 个—CH3,其余为—OH,则—OH 的个数为
(3)主链上有4个碳原子的某种烷烃,有2种同分异构体,含有相同碳原子数且主链上也有4个碳原子的单烯烃的同分异构体有 种
(4)由乙炔和乙醛组成的混合气体,经测定其中含碳元素的质量分数为72%,则混合气体中氧元素的质量分数为
(9分) (1)水的电离平衡曲线如图所示,若A点表示25°C时水的电离达平衡时的离子浓度,B点表示100°C时水的电离达平衡时的离子浓度。

①100°C时1mol·L﹣1的NaOH溶液中,由水电离出的c(H+)= mol·L﹣1,KW(25°C)
KW(100°C)
(填“>”、“<”或“=”)。
②25°C时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是 (填“促进”“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
|
化学式 |
电离常数(25℃) |
|
HCN |
K=4.9×l0-10 |
|
CH3COOH |
K=1.8×l0-5 |
|
H2CO3 |
K1=4.3×l0-7、K2=5.6×l0-11 |
③25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的pH由大到小的顺序为 。
④25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,混合后所得溶液显碱性,则c(Na+) c(CH3COO-)(填“>”、“<”或“=”)。
⑤向NaCN溶液中通入少量CO2,所发生反应的化学方程式为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com