
题目列表(包括答案和解析)


| ||
| ||


| ||
| ||
| ||
| ||
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋 资源。试回答下列问题:
资源。试回答下列问题:
(1)海水中含有大量的氯化钠。氯化钠中的金属元素化合价为 ;除去NaCl溶液中的SO42-,可依次加入 、 和 三种溶液。
和 三种溶液。
(2)目前国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是 将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填“物理变化”、
将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填“物理变化”、 “化学变化”),蒸馏法所用的主要玻璃仪器有________________________(写三种)。
“化学变化”),蒸馏法所用的主要玻璃仪器有________________________(写三种)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
食盐+H2O NaOH+H2+Cl2(未配平)。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐 t 。
NaOH+H2+Cl2(未配平)。利用电解所得气体制36.5%的浓盐酸100t,最少需要消耗食盐 t 。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法流程如下: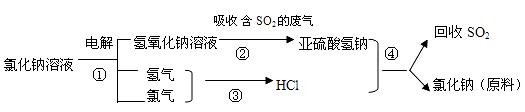
写出反应②③的化学反应方程式: , 。
海水占地球总储水量的97%以上。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)目前国际上使用的“海水淡化”主要技术有_______________________________________。
(2)工业上利用电解饱和食盐水可制得重要化工产品,用离子交换膜电解槽电解饱和食盐水,反应的离子方程式是__________________________________________________________,
阳离子交换膜的作用是________________________________________________________。
若不使用离子交换膜法电解食盐水,可得到一种消毒液,其反应的化学方程式是
________________________________________________________________________。
(3)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,写出此过程中SO2被吸收以及又生成可被回收的气体的两个反应的化学方程式________________________________________________________________________。
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量的氯化钠,氯化钠中的金属元素位于元素周期表第__________族。
(2)目前国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是____________(填物理变化或化学变化)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为食盐+H2O![]() NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是____________。利用电解所得气体制36.5%的浓盐酸1 000 t,最少需要消耗食盐____________t。
NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是____________。利用电解所得气体制36.5%的浓盐酸1 000 t,最少需要消耗食盐____________t。
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:

写出②④的化学反应方程式:____________________________________________。
上述亚硫酸氢钠与甲醛经过一定反应可以合成俗称“吊白块(雕白粉)”的物质。因吊白块对人体有害,不能用于食品漂白。其结构简式为HOCH2SO3Na,根据其结构特点,吊白块能发生的反应有____________。
A.皂化反应
B.聚合反应
C.与金属钠反应
D.氧化反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com