
题目列表(包括答案和解析)
(1)他能否制得较纯净的Na2CO3? 。理由: 。?

图7-7
(2)按他的设计,第①步实验装置如图7-7。?
①装置A使用的试剂是石灰石和盐酸溶液,可否使用纯碱代替石灰石? ,原因是 。?
②装置B使用的试剂是 ,作用是 。?
③为了便于后续实验的煮沸、混合等操作,装NaOH溶液的容器还可使用 (填仪器名称)。?
(3)有人认为将实验步骤②③的顺序对调,即先混合,再煮沸会更合理,你认为对吗? (填“合理”或“不合理”),为什么? 。
I、二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl更好。
⑴ 在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是 。
⑵ 用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。
饮用水中的ClO2、ClO2—含量可用连续碘量法进行测定。ClO2被I—还原为ClO2—、Cl—的转化
率与溶液pH的关系如下图所示。当pH≤2 .0时,ClO2—也能被I—完全还原为Cl—。反应生成
的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
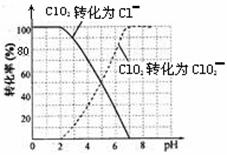 ①请写出pH≤2 .0时ClO2—与I—反应的离子方程式 。
①请写出pH≤2 .0时ClO2—与I—反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4: 加入少量淀粉溶液,用c mol·L-1Na2S2O3
溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水中ClO2—的浓度为 mol·L-1(用含字母的代数式表示)。
II.(11分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:

⑴ 在农业生产中,滤液1可用作 。
⑵ 流程中生成高铁酸钾的离子方程式是: ,控制此反应温度30℃以下的原因是: 。
⑶结晶过程中加入浓KOH溶液的作用是: 。
⑷某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是2:3,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 。
⑸实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在 附近、反应时间应控制在 。

2008年我国成功回收“神舟七号”载人飞船,这标志着“我国的载人航天事业又迈出了新的重要一步”:
⑴飞船返回时,由于与大气层的剧烈摩擦,产生高温。为了防止飞船温度过高,在飞船表面涂上一种特殊的涂料,该涂料的性质最可能的是
A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能发生分解
(2)火箭升空需要高能的燃料,肼(N2H4)是发射航天飞船常用的高能燃料。一般将液态N2O4作为火箭的推进剂。已知1mol液态肼与足量液态N2O4完全反应放出QkJ的热量,产物是对环境无害的氮气和水蒸气。写出该反应的热化学方程式 。该反应中被氧化的原子与被还原的原子物质的量之比是 。但实际发射过程中会看到有大量红色的烟雾,除了该反应可能产生少量NO外,产生此现象的原因可能是 。
(3)实际上,最理想的燃料是燃烧热大、体积小、本身毒性小、安全的固态氢,目前人们还不能制得固态氢,因为 。
(4)飞船返回时,对宇航员要进行严格的体检。人体血液的pH变化范围较小,pH只能在7.0~7.8的范围内变化,否则将会有生命危险。实验证明,在50mL的血液中加入1滴(0.05mL)10mol/L的盐酸时,pH由7.4降至7.2,如果向50mL、pH为7.4的NaOH溶液中加入1滴(0.05mL)10mol/L盐酸时,pH大约将变为 。显然,人体血液具有 的作用。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com