
题目列表(包括答案和解析)
在50 mL 0.2 mol·L-1硫酸铜溶液中插入两个电极,通电电解(不考虑水分蒸发)。则:
(1)若两极均为铜片,试说明电解过程中浓度将怎样变化___________________________。
(2)若阳极为纯锌,阴极为铜片,阳极反应式是___________________________________。
(3)如不考虑H+在阴极上放电,当电路中有0.04 mol电子通过时,阴极增重__________g,阴极上的电极反应式是__________。
(6分)某实验活动小组在实验室进行中和反应反应热的测定。请回答下列问题:
(1)测定中和反应反应热的实验装置如图所示。在两个烧杯之间填弃碎泡沫塑料的目的是 。
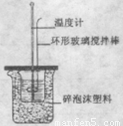
(2)在进行中和反应反应热的测定中,量取50 mL 0.50mol/L的盐酸,倒入小烧杯中,测量盐酸的温度,然后需加入下列 试剂(填序号)
①50mL 0.50mol/L NaOH溶液
②50mL 0.55mol/L NaOH溶液
③1.0g NaOH固体
(3)下述情况会使中和反应反应热的测定结果偏小的是(填序号)
a.用量筒量取50mL 0.50mol/L的盐酸时仰视读数
b.分多次把(2)中所选试剂倒入盛有盐酸的小烧杯中
c.用醋酸代替盐酸
(12分)中和热是在稀溶液中,酸和碱反应生成1mol水所放出的热量。某同学利用50 mL 、0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和热测定的实验,回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是(量筒除外)___________________。
(2)为保证该实验成功该同学采取了许多措施,如图的碎塑料泡沫的作用在于___________。
(3)用60 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所求的中和热_________________(填“相等”“不相等”)
(4)用正确的方法测得含有11.2 g KOH的稀溶液与1 L 0.1 mol/L的H2SO4溶液反应,放出11.46 kJ热量,表示其中和热的热化学方程式为____________________ ____。
2NO2+2NaOH====NaNO2+NaNO3+H2O
NO2+NO+2NaOH====2NaNO2+H2O
(1)若在标准状况下有NO、NO2的混合物恰好与50 mL 2.0 mol·L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4∶1,则在混合气体中NO气体的体积分数为多少?
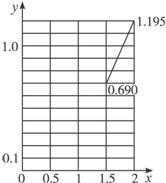
(2)设NO、NO2的混合气体用NOx表示,用碱液吸收,生成硝酸钠及亚硝酸钠再结晶分离。若生产每吨硝酸钠的成本为0.16万元,生产每吨亚硝酸钠的成本为0.27万元。目前市场出售价,硝酸钠每吨0.18万元,亚硝酸钠每吨0.28万元。则每处理22.4×109 L(标准状况)含NOx(x≥1.5)0.1%(体积分数)的尾气,所得利润y(出售价减去成本价,单位:万元)与x的关系为______________。(附解题过程)
(3)根据(2)的计算结果,在以下坐标系中作出其示意图。
用50 mL0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液,在如图所示的装置中进行中和反应。测定强酸与强碱反应的反应热。

|
|
起始温度t1/℃ |
终止温度 t2/℃ |
温度差 (t2-t1) /℃ |
||
|
HCl |
NaOH |
平均值 |
|||
|
1 |
25.5 |
25.0 |
25.25 |
28.5 |
3.25 |
|
2 |
24.5 |
24.5 |
24.50 |
27.5 |
3.00 |
|
3 |
25.0 |
24.5 |
24.75 |
26.5 |
1.75 |
(1)在该实验中,量取50 mL 盐酸或NaOH 溶液,需要用到的玻璃仪器_________。
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是______________________________。
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指______________________________温度。
(4)计算该实验发生中和反应时放出的热量为________________kJ(中和后生成的溶液的比热容c=4.18J/(g·℃ )。
(5) 如果用50 mL 0.55mol/L的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是
________________________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com