材料一:苏教版《化学1(必修)》工业上从海产品(海带)中获取碘的流程图如下:
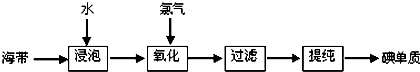
回答(1)~(3)三个小题:
(1)上述生产流程的第一步是“浸泡”,它的实验目的是
;
(2)“氧化”这一操作中可供选用的试剂:Cl
2、Br
2、浓硫酸和H
2O
2(滴加稀硫酸),从无污染角度考虑,你认为选择的合适试剂是
,反应中I
-转化为I
2的离子反应方程式为
;
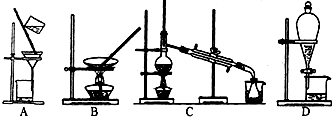
(3)上述的生产流程中,“提纯获得单质碘”一般认为经历两步,你认为应选择的实验装置分别是
(按操作的先后顺序填写);
材料二:我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
淡干海带→浸泡→浸泡液净化→上层清液→酸化→氧化→离子交换树脂吸附→解吸→碘析→精制→成品碘↓残渣(加热)→上层清液→返回
试回答(4)~(6)三个小题:
(4)实际工业生产中,酸化、氧化的方法是先加入硫酸酸化,使pH降低到2,然后加入次氯酸钠一类的氧化剂,使碘离子氧化.工业通常不用氯气氧化原因是:
.写出该过程的离子方程式
;
(5)有资料显示,为减少化学物质对环境的污染,工业可以采用电化学法制备,在
(填“阴极”或“阳极”)可以收集到碘单质.写出该极的电极方程式
;
(6)上述的生产流程中离子交换树脂是用碱性树脂吸附,再用亚硫酸钠一类还原剂解吸,请问树脂吸附的碘元素状态是
(填写“游离态”或“化合态”).解吸后应加入
(填写下列编号:A.氧化剂、B.还原剂)可以实现碘析.



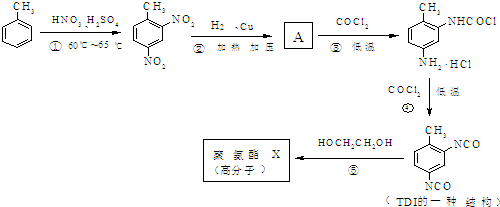
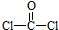
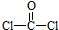
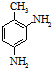

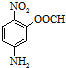

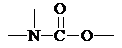 结构.第⑤步反应类型为
结构.第⑤步反应类型为






