
题目列表(包括答案和解析)
| A、盐与碱的反应 | B、氧化物与水的反应 | C、酸碱在溶液中的中和反应 | D、金属与碱溶液的反应 |
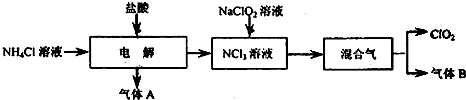
(14分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程下如下:
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为 。为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;② 。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
(3)实验室制取气体B的化学方程式为 。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将锥形瓶“在暗处静置30 min”,立即进行步骤3,则测定的结果可能
(选填“偏大”、“偏小”、“无影响”);
②上述步骤3中滴定终点的现象是 。
③根据上述步骤可计算出原ClO2溶液的浓度为 g / L(用含字母的代数式表示)。
A.溶液中只有一种阴离子(水电离的OH-除外)
B.溶液中溶质的物质的量之比为1:1
C.反应后有CO2逸出
D.CO2在溶液中恰好饱和,溶液不能再吸收CO2气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com