
题目列表(包括答案和解析)
H2O2是一种无色粘稠液体,受热易分解,沸点比水高,其水溶液呈弱酸性。工业上常用乙基蒽醌法制备H2O2:在含镍或钯的催化剂作用下,在苯溶液中用H2还原乙基蒽醌变为蒽醇,当蒽醇被氧氧化时生成过氧化氢。其转化的基本流程如下:
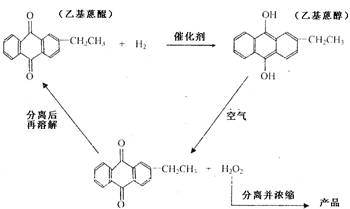
(1)实验室用稀硫酸与过氧化钡反应制取H2O2,化学方程式为 。
(2)某试剂厂先制得17%―18的H2O2溶液,再浓缩成30%溶液时,可采用的适宜方法是
(填代号)
A.常压蒸馏B.减压蒸馏C.加生石灰常压蒸馏D.加压蒸馏
(3)根据乙基蒽醌法制备过氧化氢的流程可以认为这种制备方法的实质相当于(用化学方程式表示) ,相对于实验室制法,其优点是 。
(4)科学家对H2O2结构的认识经历了漫长的过程,最初,科学家提出两种观点:
① ![]() ②H―O―O―H
②H―O―O―H
其中①式中氧氧健为配位键,即共同电子对由某原子单方面提供(在化学反应中氧氧健遇到还原剂时易断裂)。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
A.用(C2H5)2SO4与H2O2(物质的量1:1)反应,生成有机物A和H2SO4。
B.将生成的A与H2反应,(已知该反应中H2作还原剂)
①如果H2O2的结构如①所示,实验B中化学反应方程式为 ;
如果H2O2的结构如②所示,则实验B中化学反应方程式为 。
②为了进一步确定H2O2的结构,还需在实验B后添加一步实验C,请设计C的实验方案: 。
过氧化氢(H2O2)是一种无色透明粘稠状液体,它的水溶液俗称双氧水,呈弱酸性,一种强氧化剂,漂白剂,消毒剂,是生产过氧化物的原料.
(1)写出H2O2的电子式_________________,
(2)H2O2与强碱反应可生成正盐,一定条件下也生成酸式盐,写出NaOH与H2O2反应生成酸式盐的化学方程式:____________________.
(3)在H2O2中加入少量苯,再滴人数滴K2Cr2O7的硫酸溶液,振荡静置,苯层呈蓝色,这是由于反应生成过氧化铬(CrO5)溶于苯的缘故,已知过氧化铬的结构式为:①写出该反应的离子方程式:________________
②这个反应是否是氧化还原反应?________,其理由是________
(4)双氧水属于________(A强电解质、B弱电解质、C非电解质、D以上都错),它被称为“绿色氧化剂”,理由是__________________________________.
过氧化氢(H2O2)是一种无色粘稠液体,其水溶液又俗称双氧水,呈弱酸性,医疗上用作外科消毒剂。研究表明:H2O2具有立体结构,两个氢原子像在半展开书本的两页纸上,两页纸面的夹角约为94°,氧原子在书的夹缝上,O-H键与O-O键之间的空间夹角约为97°
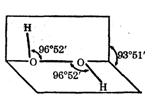
⑴H2O2的电子式为 ,其分子属于 (填:“极性”或“非极性”)分子。
⑵经测定,H2O2为二元弱酸,其酸性比碳酸弱,请写出其第一步的电离方程式_____________。
⑶H2O2溶液与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为 ,
并在方程式上标出电子转移的方向与数目。
⑷为了贮存、运输、使用的方便,工业上采用“醇析法”将其转化为固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。则下列物质能使过碳酸钠较快失效的是(多选) 。
A. MnO2 B. H2S C. 稀H2SO4 D. NaHCO3
过氧化氢(H2O2)是一种无色粘稠液体,其水溶液又俗称双氧水,呈弱酸性,医疗上用作外科消毒剂。研究表明:H2O2具有立体结构,两个氢原子像在半展开书本的两页纸上,两页纸面的夹角约为94°,氧原子在书的夹缝上,O-H键与O-O键之间的空间夹角约为97°
⑴H2O2的电子式为 ,其分子属于 (填:“极性”或“非极性”)分子。
⑵经测定,H2O2为二元弱酸,其酸性比碳酸弱,请写出其第一步的电离方程式_____________。
⑶H2O2溶液与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为 ,
并在方程式上标出电子转移的方向与数目。
⑷为了贮存、运输、使用的方便,工业上采用“醇析法”将其转化为固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。则下列物质能使过碳酸钠较快失效的是(多选) 。
A. MnO2 B.H2S C. 稀H2SO4 D.NaHCO3
过氧化氢(H2O2)是一种无色粘稠液体,其水溶液又俗称双氧水,呈弱酸性,医疗上用作外科消毒剂。研究表明:H2O2具有立体结构,两个氢原子像在半展开书本的两页纸上,两页纸面的夹角约为94°,氧原子在书的夹缝上,O-H键与O-O键之间的空间夹角约为97°
⑴H2O2的电子式为 ,其分子属于 (填:“极性”或“非极性”)分子。
⑵经测定,H2O2为二元弱酸,其酸性比碳酸弱,请写出其第一步的电离方程式_____________。
⑶H2O2溶液与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为 ,
并在方程式上标出电子转移的方向与数目。
⑷为了贮存、运输、使用的方便,工业上采用“醇析法”将其转化为固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。则下列物质能使过碳酸钠较快失效的是(多选) 。
| A.MnO2 | B.H2S | C.稀H2SO4 | D.NaHCO3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com