
题目列表(包括答案和解析)
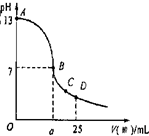 现有一瓶浓度为0.2mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种.
现有一瓶浓度为0.2mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种.| A、1 mol?L-1的NaCl溶液是指此溶液中含有1 mol NaCl | B、1L 0.5mol?L-1的NaCl溶液中取出100mL溶液,其物质的量浓度变为0.1mol?L-1 | C、6.2gNa2O溶于1L水中所得溶液的物质的量浓度为0.2mol?L-1 | D、1 mol?L-1的CaCl2溶液中,Cl-的物质的量浓度为2 mol?L-1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com