
题目列表(包括答案和解析)
回答实验室制取NH3并进行氨气性质实验的若干问题,根据要求填写空白.
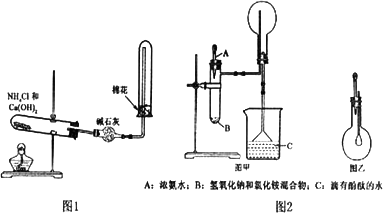
(1)实验室用图1所示装置制备干燥的NH3:
①反应的化学方程式为:________.装置中收集NH3的试管口放置棉花团的作用是:________.
②干燥管中干燥剂能否改用无水CaCl2________,理由是________.
(2)图2是某化学小组制备NH3并进行性质实验时的改进装置.按图甲把仪器安装好,称取2 g固体氯化铵装入试管底部,再快速称取2 g氢氧化钠覆盖在氯化氨上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2 mL浓氨水);烧杯内盛满有酚酞试液的水;把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大量气泡产生.
将图甲中收满NH3的圆底烧瓶取下,改装成图乙所示的装置,胶头滴管内事先吸入2 mL H2O,此时小气球系在玻璃棒上呈自然松弛状态;将滴管内的水慢慢滴入烧瓶中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某项性质.
①下面是某同学关于某化学小组能用图甲制取NH3的原因分析,有道理的是________.
a.在NH3·H2O中有平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH
NH![]() +OH-,NaOH使平衡向左移动
+OH-,NaOH使平衡向左移动
b.在NH3·H2O中有平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH
NH![]() +OH-,NH4Cl使平衡向左移动
+OH-,NH4Cl使平衡向左移动
c.NaOH溶于水时放热,使体系的温度升高,NH3的溶解度减小,会有部分NH3逸出
d.NH4Cl与NaOH在此情况下可反应生成NH3,即NH![]() +OH-
+OH-![]() NH3↑+H2O
NH3↑+H2O
e.NH4Cl会分解释放出NH3
②图甲中的NH4Cl与NaOH固体混合物能否用CaO固体代替?________(填“能”或“不能”).
③如何判断图甲中烧瓶已收满NH3?________.
④图乙中随胶头滴管中的水挤入烧瓶中,观察到的现象是________,说明NH3________.
(10分)实验室利用如图装置进行中和热的测定。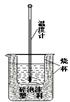
回答下列问题:①如图装置中,为了酸碱能更充分地反应,应该增加一个 (填玻璃仪器名称);大烧杯上没有盖上硬纸板,测得的中和热数值将会 (填“偏大”、“偏小”或“无影响”)。
②在操作正确的前提下提高中和热测定的准确性的关键是 ( 填代号)
A.进行实验时的气温 B.装置的保温隔热效果 C.实验所用酸碱溶液的体积
③如果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数值将 (填“偏大”、“偏小”、“不变”);原因是 。
某课外活动小组用如图装置进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则B极的电极反应式为________________。
(2)若开始时开关K与b连接,则B极的电极反应式为________,总反应的离子方程式为__________________________。
有关上述实验,下列说法正确的是(填序号)________________。
①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为________________。此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或“D”)________导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因
______________________________________________________________。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为________________。
某课外活动小组用如图装置进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为 ,
总反应的离子方程式为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为 。
此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
某课外活动小组用如图装置进行实验,试回答下列问题。
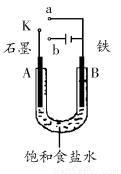
(1)若开始时开关K与a连接,则B极的电极反应式为________________。
(2)若开始时开关K与b连接,则B极的电极反应式为________,总反应的离子方程式为__________________________。
有关上述实验,下列说法正确的是(填序号)________________。
①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润的KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
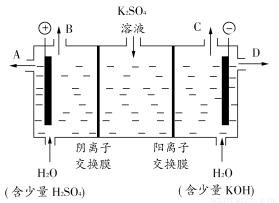
①该电解槽的阳极反应式为________________。此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或“D”)________导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因
______________________________________________________________。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com