
题目列表(包括答案和解析)

A.A(g)+2B(g)![]() 3C(g);ΔH=a a>0
3C(g);ΔH=a a>0
B.3C(g)![]() A(g)+2B(g);ΔH=a a<0
A(g)+2B(g);ΔH=a a<0
C.A(g)+2B(g)![]() 3C(l);ΔH=a a<0
3C(l);ΔH=a a<0
D.3C(l)![]() A(g)+2B(g);ΔH=a a<0
A(g)+2B(g);ΔH=a a<0
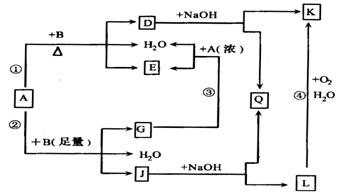
有关物质有如下图所示的转化关系。其中,A的浓溶液与单质B在加热时才发生反应①,A的稀溶液与足量B不加热也发生反应②,D的稀溶液与苯酚溶液混合后呈紫色。据此填空:
(1)写出下列物质的化学式:
A_______________,D_______________,E_______________。
(2)反应④的现象是_________________________________;
(3)写出反应②的离子方程式:______________________________;
(4)过量A的浓溶液与单质B加热时能否产生G?为什么?(结合图给信息回答)
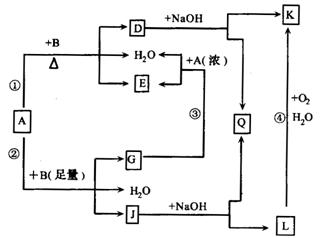
(1)写出下列物质的化学式:
A_______________,D_______________,E_______________。
(2)反应④的现象是____________________________________________________;
(3)写出反应②的离子方程式:_______________________________________________;
(4)过量A的浓溶液与单质B加热时能否产生G?为什么?(结合图给信息回答)
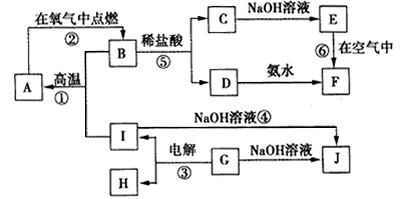
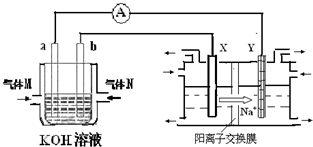 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.| 1 |
| 2 |
| 1 |
| 2 |
| 物质的量/(mol)/时间(h) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com