
题目列表(包括答案和解析)
将27.2 g Fe与Fe2O3的混合物投入足量的稀H2SO4中,反应完毕后,共放出H2 2.24 L(标准状况),在溶液中滴入KSCN溶液后不显红色,则混合物中Fe和Fe2O3的质量各是多少?
|
设nA代表阿伏加德罗常数的值,下列说法正确的是 | |
A. |
1 mol O3中电子总数为24 nA |
B. |
1 L 0.1 mol·L-1 Al2(SO4)3溶液中Al3+总数为0.2 nA |
C. |
常温常压下,22.4 L SO2和O2的混合气体中氧原子总数为2 nA |
D. |
5.6 g Fe与足量Cl2反应时转移电子总数为0.3 nA |
| |||||||||||||||||||||||||
氯化亚铜(CuCl)是重要的化工原料.国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5%.
工业上常通过下列反应制备CuCl:
2CuSO4+Na2SO3+2NaCl+Na2CO3=2CuCl↓+3Na2SO4+CO2↑
(1)CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4·5H2O与H2O的质量之比.
(2)准确称取所制备的0.2500 g·CuCl样品置于一定量的0.5 mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.1000 mol·L-1 Ce(SO4)2溶液滴定到终点,消耗24.60 mL Ce(SO4)2溶液.有关反应的离子方程式为:
Fe3++CuCl=Fe2++Cu2++Cl-,Ce4++Fe+=Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准.
铁元素及其化合物与人类的生产生活息息相关,回答下列问题
(1)铁酸钠(Na2FeO4)是一种新型水处理剂,它有比高锰酸钾更强的氧化性,在水中反应被还原为Fe3+.
①铁酸钠中铁元素的化合价为________.
②铁酸钠用于水处理,除了能消毒杀菌外,还可以像明矾(KAl(SO4)2)一样起到净水作用,请说明明矾的净水原理:________.(用离子方程式表示)
(2)反应ⅠFe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;
反应ⅡCO(g)+1/2O2(g)=CO2(g) ΔH=b kJ·mol-1
测得在不同温度下,K值如下:
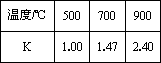
①写出K的表达式________.
②反应Ⅰ中的a________0(填大于、小于、等于).
③若500℃时进行反应Ⅰ,CO2起始浓度为2 0mol·L-1,CO的平衡浓度为________mol·L-1.
④700℃反应Ⅰ达到平衡,要使得该平衡向右移动,其它条件不变时,可以采取的措施有________(填序号).
A.缩小反应器体积
B.通入CO2
C.升高温度到900℃
D.使用合适的催化剂
⑤由反应Ⅰ和Ⅱ可求得,反应2Fe(s)+O2(g)=2FeO(s)的ΔH=________kJ·mol-1.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160 mL 5 mol·L-1盐酸中,再加入一定量铁粉恰好完全溶解,收集到气体2.24 L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为________g.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com