
题目列表(包括答案和解析)
有机物A、B均稳定,且分子式相同。取0.1mol A完全燃烧,得二氧化碳26.4g。A、B分别跟足量的乙酸并在浓硫酸存在条件下反应,生成C、D两种有机物,C的相对分子质量比D的相对分子质量大42。B、E以任意质量比混合,只要总质量不变,完全燃烧后耗氧气量和生成的水量都不变。0.1mol E能与足量银氨溶液反应生成43.2g银,且E的相对分子质量小于58。B能与新制氢氧化铜的悬浊液反应生成红色沉淀。A的任意一个羟基被溴原子取代所得的一溴代物都只有一种。
(1)通过计算和推理,确定A、B、E各物质的结构简式分别为:
A
B
E
(2)写出B→D和B与新制氢氧化铜的悬浊液的化学反应方程式(有机物写结构简式)。
B→D:
B与新制氢氧化铜:
(3)B与乙酸在一定条件下反应的有机产物中分子量在221至265之间的有机产物总共有
种。
丙酸的结构为CH3—CH2—COOH,丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的生产工艺流程如下:
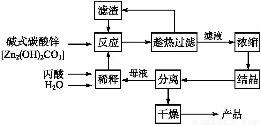
序号 | n(丙酸)∶ n(碱式碳酸锌) | 反应温度/℃ | 丙酸锌产率/% |
1 | 1∶0.25 | 60 | 67.2 |
2 | 1∶0.25 | 80 | 83.5 |
3 | 1∶0.25 | 100 | 81.4 |
4 | 1∶0.31 | 60 | 89.2 |
5 | 1∶0.31 | 80 | 90.1 |
6 | 1∶0.31 | 100 | 88.8 |
(1)探究本实验中最佳工艺条件(见上表):反应时间2 h,用水量45 g,n(丙酸)∶n(碱式碳酸锌)=1∶ ,反应温度 ℃。
,反应温度 ℃。
(2)本工艺采用“闭路循环”方式,除具有制备工艺简便、产率高外,还具有 的优点。
(3)某次实验时,将37.0 g丙酸溶于220 mL水中,按上述流程在上述优化的条件下制备,最终得丙酸锌49.6 g,则该次实验丙酸锌的产率为 (写出计算过程)。
分析下表中的四个热化学方程式,判断氢气 和丙烷的燃烧热分别是( )
| “嫦娥一号”发射火箭燃料 | 液氢(H2) | ①2H2(g)+O2(g) ②2H2(g)+O2(g) |
| 北京奥运会“祥云”火炬燃料 | 丙烷 (C3H8) | ③C3H8(l)+5O2(g) ΔH=-2 013.8 kJ·mol-1 ④C3H8(g)+5O2(g) ΔH=-2 221.5 kJ·mol-1 |
A.571.6 kJ·mol-1,2 221.5 kJ·mol-1
B.241.3 kJ·mol-1,2 013.8 kJ·mol-1
C.285.8 kJ·mol-1,2 013.8 kJ·mol-1
D.285.8 kJ·mol-1,2 221.5 kJ·mol-1
下列有关热化学方程式及其叙述正确的是
A.氢气的燃烧热为285.5 kJ?mol-1,则水分解的热化学方程式为:( )
2H2O(l)=2H2(g)+O2(g);△H=+285.5 kJ?mol-1
B.已知2C(石墨,s)+O2(g)=2CO(g);△H=-221 kJ?mol-1,
则石墨的燃烧热为110.5 kJ?mol-1
C.已知N2(g)+3H2(g) ![]() 2 NH3(g) ;△H=-92.4 kJ?mol-1,则在一定条件下将
2 NH3(g) ;△H=-92.4 kJ?mol-1,则在一定条件下将
1molN2和3molH2置于一密闭容器中充分反应后,最多可放出92.4kJ的热量
D.已知乙醇和乙烯的燃烧热分别为1366.8kJ?mol-1和1411.0 kJ?mol-1,
则乙烯水化制乙醇的热化学方程式为:
C2H4(g)+H2O(l)=C2H5OH(l); △H=-44.2kJ?mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com