
题目列表(包括答案和解析)
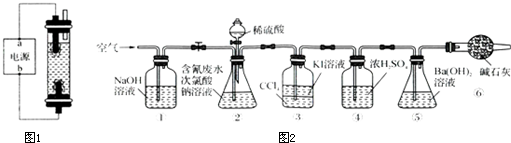

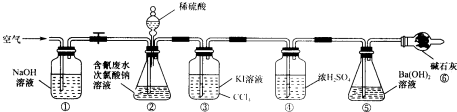
| 实验 | c(H2SO4)mol.L-1 | V(H2SO4)mL | V(NaClO)mL | 含氯废水的体积mL |
| 1 | 100 | 100 | ||
| 2 | 0.0500 | 100 | 100 | |
| 3 | 0.2000 | 100 | 100 |
如图,将2 mL浓度为6 mol/L的盐酸用注射器通过橡皮塞慢慢注入,玻璃管中出现小气泡,气泡在溶液中逐渐上升的过程中消失。对该反应过程的推断不合理的是:
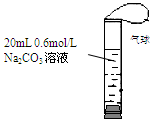
A.有反应CO32- + 2H+ → CO2↑ + H2O发生
B.有反应CO32- + H+ → HCO3-发生
C.有反应CO32- + CO2 + H2O→ 2HCO3-发生
D.加快盐酸注入速度不会改变反应现象
(1)将100 mL浓度为1 mol·L-1的Na2CO3溶液滴入到浓度为1.2 mol·L-1的100 mL盐酸溶液中,计算生成CO2的体积(在标准状况下)。
(2)将100 mL浓度为1.2 mol·L-1的盐酸溶液逐滴滴入到浓度为1 mol·L-1的100 mL Na2CO3溶液中,计算生成CO2的体积(在标准状况下)。对比二者结果有何不同。

| 实验 | c(H2SO4)mol.L-1 | V(H2S O4)mL | V(NaClO)mL | 含氯废水的体积mL |
| 1 | ______ | 100 | ______ | 100 |
| 2 | 0.0500 | ______ | 100 | 100 |
| 3 | 0.2000 | ______ | 100 | 100 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com