
题目列表(包括答案和解析)


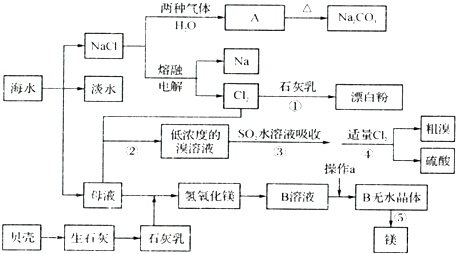
海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:

请回答:
(1)Mg(OH)2中加入盐酸中,要获得MgCl2?6H2O晶体,需要进行的实验操作依次为
;
(2)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是 ;
A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(3)母液中常含有MgCl2、NaCl、MgSO4、KCl等,可进一步加工制得一些重要的产品。若将母液加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是 ;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的 晶体。
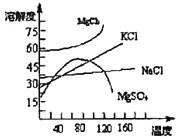
 海水中常含MgCl2、NaCl、MgSO4、KCl等,加工后可制得一些重要的产品.若将海水加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分为甲;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到较纯净的晶体乙.下列关于甲、乙成分的推断正确的是( )
海水中常含MgCl2、NaCl、MgSO4、KCl等,加工后可制得一些重要的产品.若将海水加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分为甲;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到较纯净的晶体乙.下列关于甲、乙成分的推断正确的是( )| A、工业上,用焦炭在高温下还原二氧化硅制得粗硅 | B、通常将氯气通入到饱和石灰水中制得大量漂白粉 | C、工业制硫酸将SO2氧化成SO3的条件一般选择高温、高压、催化剂 | D、钠可把钛、锆、铌、钽等金属从它们的卤化物溶液里还原出来 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com