
题目列表(包括答案和解析)
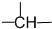 、z个
、z个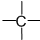 ,则-CH3最多有(用含x、y、z的代数式表示)
,则-CH3最多有(用含x、y、z的代数式表示)
 ,且E中R′的两个取代基呈对位,已知R、R′为烃基.
,且E中R′的两个取代基呈对位,已知R、R′为烃基.

 ,且属于酯的同分异构体有
,且属于酯的同分异构体有 (任写一种)
(任写一种) (任写一种)
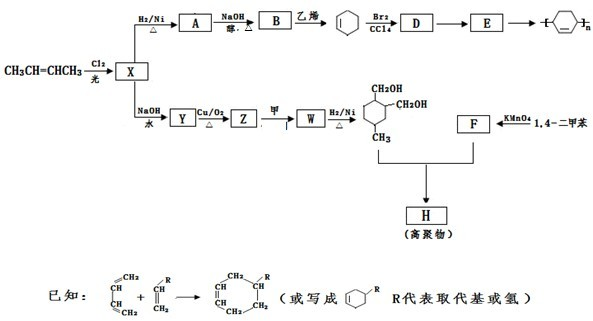
(任写一种) ,可以简写为
,可以简写为 )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:


 )与Br2为主要起始物质,通过加成、消去两步反应制得.写出由苯乙烯制取苯乙炔的两步化学方程式(其他试剂自选).
)与Br2为主要起始物质,通过加成、消去两步反应制得.写出由苯乙烯制取苯乙炔的两步化学方程式(其他试剂自选).



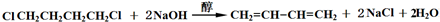


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com