
题目列表(包括答案和解析)

| 实验序号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② |
| ||
氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓)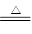 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)若制得标准状况下11.2 L Cl2,则被氧化的HCl为___________mol。
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为__________。
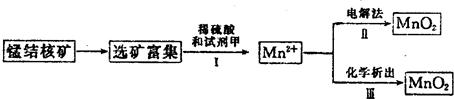
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
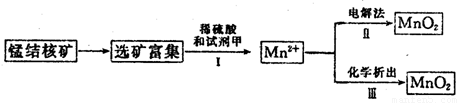
①步骤Ⅰ中, 试剂甲必须具有的性质是____________(填序号)。
A.氧化性B.还原性C.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL,该反应的离子方程式为___________________________。
(4)用100mL12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为___________________________。
氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓)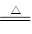 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)若制得标准状况下11.2 L Cl2,则被氧化的HCl为___________mol。
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为__________。
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
①步骤Ⅰ中, 试剂甲必须具有的性质是____________(填序号)。
A.氧化性B.还原性C.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL,该反应的离子方程式为___________________________。
(4)用100mL12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为___________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com