
题目列表(包括答案和解析)
|
今有反应X(g)+Y(g)
| |
| [ ] | |
A. |
增大了X和Y的浓度 |
B. |
使用了催化剂 |
C. |
增加了反应体系的压强 |
D. |
升高了反应的温度 |
2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ/mol(N2的键能为942kJ/mol),晶体片段结构如图所示。又发现从N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是:
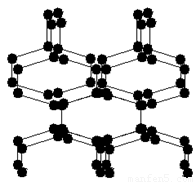
A.该晶体中含有非极性共价键
B.含N5+离子的化合物中既有离子键又有共价键
C.高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D.这种固体的可能潜在应用是烈性炸药或高能材料

表1 物质沉淀时的pH
物 质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
完全沉淀的pH | 3.7 | 9.6 | 6.4 |
表2 备选试剂
序 号 | A | B | C | D | E |
化学式 | NaOH | CuO | H2O2 | 稀HNO3 | KMnO4 |
回答下列问题:
(1)X_________;Y_________。(填写备选试剂中的序号)
(2)沉淀(Ⅱ)的化学式_____,证明步骤③中沉淀是否完全的操作方法是____________。
(3)第⑤步骤操作中,所需装置如图所示:

按气流从左至右的方向,各装置接口的连接顺序为_________。
D装置的作用是______________________;理由______________________。
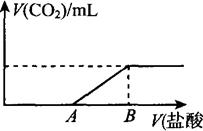
(8分)标准状况下,向1 00 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的pH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
00 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的pH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
 k+s-5#u
k+s-5#u
已知图中B点位置固定,V(B)="300" ml。,而点A、C可在各自的轴上移动。
(1)原溶液的物质的量浓度为 mol/L,B点时,最终所得溶液中的溶质的物质的量浓度是 mol/L。(两种溶液混合时体积可以直接相加)。
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
| V(A)的取值 | V(A)=0 | 0<V(A)<150 | V(A)=150 | 150<V(A)<300 |
| 溶质的成分 | ① | ② | ③ | ④ |
 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g) 的浓度随时间变化如图所示
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g) 的浓度随时间变化如图所示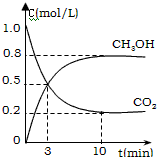
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com