
题目列表(包括答案和解析)
(1)C元素在周期表中的位置是_________;液态X类似B2A,也可微弱电离且产生电子数相同的两种离子,则液态X的电离方程式为__________________。
(2)Y离子中D—B键的键角为_________,![]() 是由中性分子结合质子形成的,有类似Y离子的性质,写出
是由中性分子结合质子形成的,有类似Y离子的性质,写出![]() 与过量强碱溶液反应的离子方程式:
与过量强碱溶液反应的离子方程式:
_______________________________________________________________。
(3)M、N是由A、B、C、D四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液显强碱性,N的水溶液呈酸性,且M溶液中水的电离程度小于N溶液中
水的电离程度。则M、N分别是(填化学式)___________________________,_____________
____________;若将0.1 mol/L的M和0.2 mol/L的N两溶液等体积混合,则所得溶液中离子浓度的大小顺序为__________________。
| 元素 | A | B | C | D | |
| 性质或结构信息 | 室温下单质呈气态,原子最外层电子数与D相同. | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软,银白色固体,导电性强,在空气中燃烧生成淡黄色固体 | E是一种气态氧化物丙,丙相对于空气的密度为3.0,溶解于水可得只含单一溶质的弱酸性溶液,该溶液在光照条件下放置酸性会增强 |
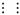
(1)若A为金属钠,且加入的A足量,B是由短周期元素组成的化合物,则白色沉淀D为(填化学式)___________。
(2)若气体C燃烧时火焰明亮,伴有浓的黑烟,则C的电子式为____________,若C的燃烧热为1300 kJ·mol-1,则1 mol C燃烧生成液态水时的热化学方程式为:__________________。
(3)B为正盐,D不溶于稀HNO3,C能使湿润的蓝色石蕊试纸变红,C在化工生产有广泛的用途,任写出其中两种用途___________,足量A的溶液和B的溶液在加热时反应的离子方程式为:__________。
(4)若B为Al2(SO4)3,D具有两性,且A、D的相对分子质量相等,则A为___________(化学式),当产生与B等物质的量的D时,则A、B的物质的量之比可能为:____________或___________。


 A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图,B的最外层电子数比K层电子多1,D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空:
A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图,B的最外层电子数比K层电子多1,D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空:

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com