
在两个体积均为1L的恒容容器a和b中模拟一碳化学合成甲醛,合成过程中的原理可表示为CO(g)+H
2(g)?HCHO(g),其中容器a中使用催化剂.两容器中CO和H
2的物质的量相同,均为1mol.试回答下列问题:
(1)下列关系中能说明上述反应已经达到平衡状态的是
ABD
ABD
(填序号).
A.v
正(CO)=v
逆(H
2)
B.v
正(H
2)=v
逆(HCHO)
C.容器内气体的密度保持不变
D.容器内气体的压强保持不变
(2)在相同条件下,某同学作出了在有催化剂时(a)和无催化剂时(b)速率-时间图象,如图所示.请你对该图象作出正确的评价
该题是错误的,原因是题中给出的是速率-时间图象,由于催化剂能改变反应速率,因此达到平衡状态时两容器中氢气的反应速率不相等
该题是错误的,原因是题中给出的是速率-时间图象,由于催化剂能改变反应速率,因此达到平衡状态时两容器中氢气的反应速率不相等
.
(3)为了在a容器中寻找合成甲醛的适宜温度和压强,某同学设计了两组实验,部分实验条件已经填在实验设计表中.请在空格中填入剩余的实验条件数据.
| 实验编号 |
T(℃) |
n(CO)/n(H2) |
p(Mpa) |
| Ⅰ |
150 |
|
0.1 |
| Ⅱ |
150 150 |
|
5 |
| Ⅲ |
350 |
|
5 |


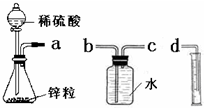 某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.
某化学实验小组的同学用下列仪器组装两套完全相同的装置定量探究浓度对反应速率的影响.
 在两个体积均为1L的恒容容器a和b中模拟一碳化学合成甲醛,合成过程中的原理可表示为CO(g)+H2(g)?HCHO(g),其中容器a中使用催化剂.两容器中CO和H2的物质的量相同,均为1mol.试回答下列问题:
在两个体积均为1L的恒容容器a和b中模拟一碳化学合成甲醛,合成过程中的原理可表示为CO(g)+H2(g)?HCHO(g),其中容器a中使用催化剂.两容器中CO和H2的物质的量相同,均为1mol.试回答下列问题: 哥本哈根会议虽未能就减排问题达成有约束力的协议,但各国对于CO2对气候的影响达成了共识,都在积极研究方法循环利用CO2.CO2(g)与H2(g)反应可生成CH3OH(g)和H2O(g).某实验小组为研究该反应进行了如下实验.在某温度下,向容积为10L的恒温恒容容器中充入a mol CO2和a mol H2,测得不同时刻的c(H2)如右表.
哥本哈根会议虽未能就减排问题达成有约束力的协议,但各国对于CO2对气候的影响达成了共识,都在积极研究方法循环利用CO2.CO2(g)与H2(g)反应可生成CH3OH(g)和H2O(g).某实验小组为研究该反应进行了如下实验.在某温度下,向容积为10L的恒温恒容容器中充入a mol CO2和a mol H2,测得不同时刻的c(H2)如右表. CH3OH+H2O
CH3OH+H2O CH3OH+H2O
CH3OH+H2O