
题目列表(包括答案和解析)
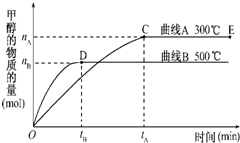 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
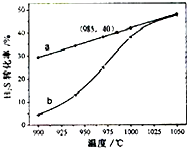 H2S受热分解的反应为:2H2S(g)→2H2(g)+S2(g).在恒温密闭容器中,控制不同温度进行 H2S分解实验.以H2S起始浓度均为cmol?L-1测定H2S的转化率,结果如图.图中a曲线为H2S 的平衡转化率与温度关系,b曲线表示不同温度下反应经过相同时间的转化率.下列叙述错误的是( )
H2S受热分解的反应为:2H2S(g)→2H2(g)+S2(g).在恒温密闭容器中,控制不同温度进行 H2S分解实验.以H2S起始浓度均为cmol?L-1测定H2S的转化率,结果如图.图中a曲线为H2S 的平衡转化率与温度关系,b曲线表示不同温度下反应经过相同时间的转化率.下列叙述错误的是( )A、985℃时,H2S按上述反应分解的平衡常数K=
| ||
| B、H2S的分解为吸热反应 | ||
| C、图象能解释,温度升高,反应速率加快 | ||
| D、如果只将上述条件中的温度改为压强,图象的形式基本不变 |

 2NH3的平衡常数K的数值为
2NH3的平衡常数K的数值为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com