
题目列表(包括答案和解析)
(8分)根据下边的实验装置图回答下列问题。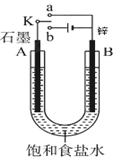
(1)若开始时开关K与a连接,则B极的电极反应式为 ;
(2)若开始时开关K与b连接,则B极的电极反应式为 ;
总反应的化学方程式为 ;
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
(8分)根据下边的实验装置图回答下列问题。
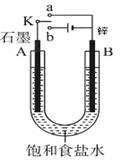
(1)若开始时开关K与a连接,则B极的电极反应式为 ;
(2)若开始时开关K与b连接,则B极的电极反应式为 ;
总反应的化学方程式为 ;
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
(8分)某有机物的结构简式为HO-CH2—CH=CH—CH=CH-CHO。
(1)请你写出下列官能团
“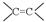 ”、“HO-”、“-CHO”的名称: 、 、 。
”、“HO-”、“-CHO”的名称: 、 、 。
(2)验证该有机物中含有“-CHO”,常采用的试剂是 ,产生的现象为 。
(3)该有机物的性质描述正确的有
| A.与金属Na反应放出O2 | B.能与新制Cu(OH)2反应,产生红色沉淀 |
| C.不能发生银镜反应 | D.一定条件下能与H2发生加成反应 |
(8分)某100mL的CuCl2溶液中,已知溶液中的Cl-的浓度为0.2 mol·L-1。现将一定量的铁粉投入到该溶液中,回答下列问题:
(1)原溶液中Cu2+的浓度为 ;
(2)反应后测得Cl-的浓度为 mol·L-1;
(3)若反应后测得Fe2+的溶液为0.05 mol·L-1,则反应生成铜单质的质量为 g;
(4)剩余的Cu2+的浓度为 。
(8分)水蒸气通过的灼热的焦炭后,流出气体的主要成分是 CO 和 H2,还有 CO2和水蒸气等.现利用下图中提供实验装置,证明上述混合气体中有CO 和 H2.(A中加热装置在图中略去)回答下列问题: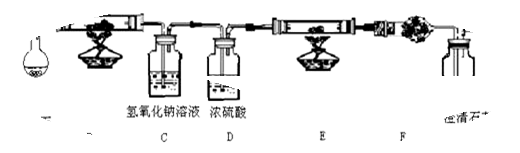
(1)C装置的用途是
(2)仪器 E 中需加入的试剂是
(3)仪器 F 中需加入的试剂是: ,其目的是
(4)能证明混合气中含有 CO 的实验现象是
(5)有人认为该实验装置存在一个缺陷,你认为这个缺陷是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com