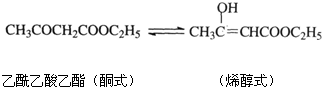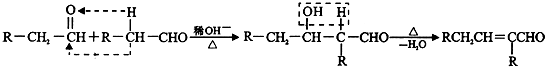(2011?台州模拟)罗伯特?格拉布等三位科学家因在烯烃复分解反应研究方面取得了显著成就而荣获2005年诺贝尔化学奖.烯烃的复分解反应机理可视为双键断裂,换位连接,如:CH
2=CHR
1+CH
2=CHR
2 
CH
2=CH
2+R
1CH=CHR
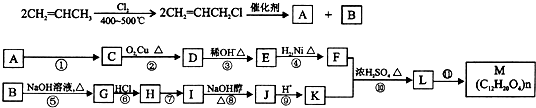
2已知:F是油脂水解产物之一,能与水任意比互溶;K是一种塑料;J的化学式为C
9H
14O
6.物质转化关系如图所示:
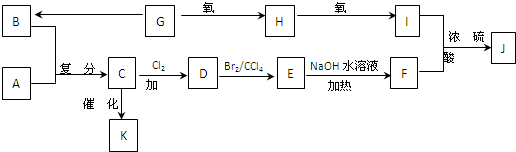
请回答下列问题:
(1)请写出下列物质的结构简式:A.
CH3CH=CHCH3
CH3CH=CHCH3
,J.
.
(2)写出 C→D的化学方程式:
CH2=CHCH3+Cl2→CH2=CHCH2Cl+HCl
CH2=CHCH3+Cl2→CH2=CHCH2Cl+HCl
,该反应的反应类型是
取代反应
取代反应
,G→B的反应类型是
消去反应
消去反应
.
(3)A与A的所有烯烃同分异构体之间,通过烯烃复分解反应后形成的新烯烃有
7
7
种结构;这些新烯烃和氯化氢在一定条件下发生加成反应,则其产物只有一种结构的新烯烃的结构简式为:CH
2=CH
2、
CH3CH2CH=CHCH2CH3
CH3CH2CH=CHCH2CH3
、
.
(4)以G为原料经过一系列反应最终可制得乙酰乙酸乙酯(无色液体),通常状况下乙酰乙酸乙酯可逐渐转化为烯醇式 (达到平衡后烯醇式约占7%):
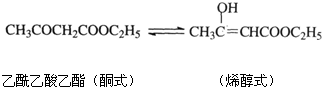
已知FeCl
3溶液可和烯醇式反应显紫色.某同学拟用5%的FeCl
3溶液和Br
2的CCl
4溶液来证明上述平衡的存在,请简要描述实验过程和现象
向乙酰乙酸乙酯中滴加几滴5%的FeCl3溶液,立即显紫色,再滴加Br2的CCl4溶液至恰好无色,然后溶液颜色又逐渐恢复紫色,即可证明
向乙酰乙酸乙酯中滴加几滴5%的FeCl3溶液,立即显紫色,再滴加Br2的CCl4溶液至恰好无色,然后溶液颜色又逐渐恢复紫色,即可证明
.

 CH2=CH2+R1CH=CHR2
CH2=CH2+R1CH=CHR2