
题目列表(包括答案和解析)
| c(CO2) |
| c(CO) |
| 0.025mol/L |
| 0.1mol/L |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
| 0.025mol/L |
| 0.1mol/L |
| c(CO2) |
| c(CO) |
 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:| c(CO2) |
| c(CO) |
| 0.025mol/L |
| 0.1mol/L |
| c(CO2) |
| c(CO) |
| 0.025mol/L |
| 0.1mol/L |
| c(CH3OH) |
| c(CO2) |
体积相同的某植物营养液两份,其配方如下:
|
|
KCl |
K2SO4 |
ZnSO4 |
ZnCl2 |
|
A |
0.3mol/L |
0.2mol/L |
0.1mol/L |
/ |
|
B |
0.1mol/L |
0.3mol/L |
/ |
0.1mol/L |
下列说法正确的是( )
A.仅c(K+)相同 B.仅c(Cl-)相同 C.完全相同 D.完全不同
(11分)在常温下,下列五种溶液:
①0.1mol/L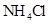 ②0.1mol/L
②0.1mol/L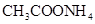 ③0.1mol/L
③0.1mol/L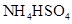
④0.1mol/L 和0.1mol/L
和0.1mol/L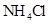 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
____________________________________________________________________________。
(2)在上述五种溶液中, 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号)
(3)比较溶液②、③中 的大小关系是② ③(填“>”、“<”或“=”)。
的大小关系是② ③(填“>”、“<”或“=”)。
(4)在溶液④中, 离子的浓度为0.1mol/L; 和 离子的物质的量浓度之和为0.2mol/L。
和 离子的物质的量浓度之和为0.2mol/L。
(5)常温下,测得溶液②的 ,则说明
,则说明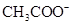 的水解程度 (填“>”、“<”或“="”" )
的水解程度 (填“>”、“<”或“="”" ) 的水解程度,
的水解程度,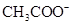 与
与 浓度的大小关系是:
浓度的大小关系是:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com