
题目列表(包括答案和解析)

(1)写出符合下列条件的三个方程式。
A.所有的反应物和生成物都由A、B、D三种元素中的一种或两种组成;
B.反应物中有且只有一种单质,三个反应中的单质不同。
_________________;_________________;_________________。
(2)A、B、D三种元素组成的BA4D与D2和KOH可组成燃料电池,该电池正极反应的物质为_________________,负极的电极反应式为_________________。
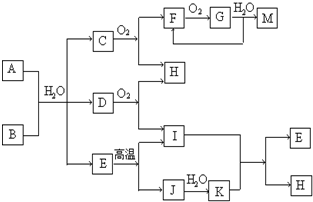
(3)在D2中完全燃烧
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
| A、R的原子半径比Z的大 | B、R的氢化物的热稳定性比W的强 | C、X与Y形成的化合物只有一种 | D、Y的最高价氧化物的水化物的酸性比W的强 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com