
题目列表(包括答案和解析)
二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx ,反应如下:
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g);△H= -574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g);△H= -1160 kJ·mol-1
则CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g);△H= ;
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图甲所示,则平衡常数K= (小数点后保留3位);
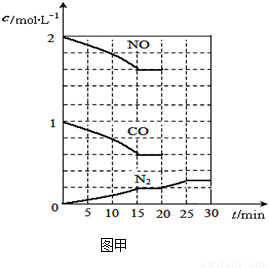
①若保持温度不变,20min时再向容器中充入CO气体0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
②若保持温度不变,20min时向原平衡容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、“向右”或“不”);
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是
(填字母);
A.加入催化剂 B.降低温度 C.缩小容器体积 D.增加CO2的量
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从 而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
CH4(g)+2NO2(g)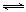 N2(g)+CO2(g)+2H2O(g)
ΔH=−867
kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g)
ΔH=−867
kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
|
实验编号 |
温度 |
时间 |
0 |
10 |
20 |
40 |
50 |
|
1 |
130℃ |
n(CH4)/mol |
0.50 |
0.35 |
0.25 |
0.10 |
0.10 |
|
2 |
180℃ |
n(CH4)/mol |
0.50 |
0.30 |
0.18 |
|
0.15 |
(1)开展实验1和实验2的目的是 。
(2)180℃时,反应到40min,体系 (填“是”或“否”)达到平衡状态,理由是 ;CH4的平衡转化率为 。
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
(4)一定条件下,反应时间t与转化率μ(NO2)的关系如图所示,请在图像中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注。

(5)根据已知求算:ΔH2= 。
CH4(g)+4NO2(g)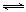 4NO(g)+CO2(g)+2H2O(g) ΔH1=−574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=−574 kJ·mol-1
CH4(g)+4NO(g)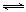 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2
一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 (g)+4NO2 (g)=4NO (g) +CO2 (g)+2H2O (g) △H=―574 kJ·mol-1
② CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (g) △H=―1160 kJ·mol一1
下列选项正确的是 ( )
A.CH4 (g)+2NO2 (g)= N2 (g)+CO2 (g)+2H2O (l) ;△H=―867 kJ·mol-1
B.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
C.CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子为3.2 mol
D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为1.6 mol
(9分)氮及其化合物与人们的生活息息相关。
(1)氮元素在周期表中的位置是 。
(2)实验室可用铜与稀硝酸反应制取NO,其离子方程式是 。为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该化学方程式是 。
(3)已知:① CH4(g)+ 4 NO2(g) = 4 NO(g) + CO2(g) +2 H2O(g) △H= -574 kJ·mol-1
② CH4(g)+ 4 NO(g) = 2 N2(g) + CO2(g) + 2 H2O(g) △H= -1160 kJ·mol-1
根据①和②,标准状况下,4.48 L CH4恰好将NO2转化为N2时,△H= 。
由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H -574 kJ·mol-1
(4)同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气完全转化为N2,则原混合
气中 NO和NO2的体积比是 。
(5)含有1mol HNO3的稀硝酸分别与不同质量的铁粉,所得氧化产物a、b与铁粉物质的量关系如下图所示。 b是 n3 = p=
“西气东输”是西部大开发的重点工程,这里的“气”指天然气,其主要成分为甲烷。
(1)工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,它们的体积比约为1∶1。已知:?
2CO(g)+O2(g)![]() 2CO2(g) ΔH=-566kJ·mol-1??
2CO2(g) ΔH=-566kJ·mol-1??
2H2(g)+O2(g)![]() 2H2O(l) ΔH=-572kJ·mol-1??
2H2O(l) ΔH=-572kJ·mol-1??
CH4(g)+2O2(g) ![]() CO2(g)+2H2O(l) ΔH=-890kJ·mol-1??
CO2(g)+2H2O(l) ΔH=-890kJ·mol-1??
若不考虑水煤气中其他成分,相同状况下要获得相等的热量,所需甲烷与水煤气的体积比约为_________,它们燃烧生成的CO2的物质的量之比约为______________?。?
以甲烷代替水煤气作民用燃气,其优点是_________。?
(2)某化工生产中用烷烃和水蒸气反应得到CO和H2为主的混合气,这种混合气可用于生产甲醇或合成氨,对甲烷而言,有如下两个主要反应:?
①CH4(g)+1/2O2(g)![]() CO(g)+2H2(g) ΔH1=-36kJ·mol-1??
CO(g)+2H2(g) ΔH1=-36kJ·mol-1??
②CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH2=+216kJ·mol-1??
CO(g)+3H2(g) ΔH2=+216kJ·mol-1??
由反应①②推出总反应热为零的总反应方程式为____________________________;求进料气中空气(O2的体积分数为21%)与水蒸气的体积比__________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com