
题目列表(包括答案和解析)
I.将状况相同的某种绿叶分成四等组,在不同温度下分别暗处理1h,再用适当的相同的光照射1h,测其重量变化(假设在光下和黑暗条件下,细胞呼吸消耗有机物量相同),得到如下表的数据。分析并回答问题:
|
组 别 |
1 |
2 |
3 |
4 |
|
温度/℃ |
27 |
28 |
29 |
30 |
|
暗处理后重量变化/mg |
-1 |
-2 |
-3 |
-1 |
|
光照后与暗处理前 重量变化/mg |
+3 |
+3 |
+3 |
+1 |
(1)该探究实验中,属于因变量的有 、 。
(2)第一组实验说明该绿叶在27℃时每小时积累的有机物的量是___________mg;29℃时真实光合速率为_______________mg/h。
Ⅱ.(7分)已知 ,可以通过观察反应过程中的生成速度(即气泡从溶液中释放的速度)来判断H2O2分解反应的速度。请用所给的实验材料和用具设计实验,使其能同时验证过氧化氢酶具有催化作用和高效性。要求写出实验步骤、预测实验结果、得出结论,并回答问题。
,可以通过观察反应过程中的生成速度(即气泡从溶液中释放的速度)来判断H2O2分解反应的速度。请用所给的实验材料和用具设计实验,使其能同时验证过氧化氢酶具有催化作用和高效性。要求写出实验步骤、预测实验结果、得出结论,并回答问题。
实验材料与用具:适宜浓度的H2O2溶液,蒸馏水,3.5% 溶液,0.01%牛过氧化氢酶溶液,恒温水浴锅,试管。
溶液,0.01%牛过氧化氢酶溶液,恒温水浴锅,试管。
(1)实验步骤:
①取3支试管,各加入等量且适量的H2O2溶液,放入37℃恒温水浴锅中保温适当时间,
② ,
③观察各管中释放气泡产生的快慢。
(2)实验结果预测及结论:
整个实验中不同处理的试管中O2的释放速度从快到慢依次是:________________ 。
由此可得出的结论是____________________________________。
(3)如果仅将实验中的恒温水浴改为80℃,重做上述实验,O2释放的速度最快的是_____________。
I.将状况相同的某种绿叶分成四等组,在不同温度下分别暗处理1h,再用适当的相同的光照射1h,测其重量变化(假设在光下和黑暗条件下,细胞呼吸消耗有机物量相同),得到如下表的数据。分析并回答问题:
| 组 别 | 1 | 2 | 3 | 4 |
| 温度/℃ | 27 | 28 | 29 | 30 |
| 暗处理后重量变化/mg | -1 | -2 | -3 | -1 |
| 光照后与暗处理前 重量变化/mg | +3 | +3 | +3 | +1 |
(1)该探究实验中,属于因变量的有 、 。
(2)第一组实验说明该绿叶在27℃时每小时积累的有机物的量是___________mg;29℃时真实光合速率为_______________mg/h。
Ⅱ.(7分)已知![]() ,可以通过观察反应过程中的生成速度(即气泡从溶液中释放的速度)来判断H2O2分解反应的速度。请用所给的实验材料和用具设计实验,使其能同时验证过氧化氢酶具有催化作用和高效性。要求写出实验步骤、预测实验结果、得出结论,并回答问题。
,可以通过观察反应过程中的生成速度(即气泡从溶液中释放的速度)来判断H2O2分解反应的速度。请用所给的实验材料和用具设计实验,使其能同时验证过氧化氢酶具有催化作用和高效性。要求写出实验步骤、预测实验结果、得出结论,并回答问题。
实验材料与用具:适宜浓度的H2O2溶液,蒸馏水,3.5%![]() 溶液,0.01%牛过氧化氢酶溶液,恒温水浴锅,试管。
溶液,0.01%牛过氧化氢酶溶液,恒温水浴锅,试管。
(1)实验步骤:
①取3支试管,各加入等量且适量的H2O2溶液,放入37℃恒温水浴锅中保温适当时间,
② ,
③观察各管中释放气泡产生的快慢。
(2)实验结果预测及结论:
整个实验中不同处理的试管中O2的释放速度从快到慢依次是:________________ 。
由此可得出的结论是____________________________________。
(3)如果仅将实验中的恒温水浴改为80℃,重做上述实验,O2释放的速度最快的是_____________。
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |

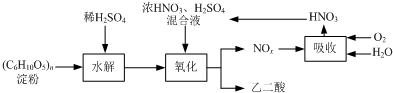
| A | ①完全燃烧的产物中n(CO2):n(H2O)=2:1 ②28<M(A)<60 ③不能使溴的四氯化碳溶液褪色 ④一氯代物只有一种结构 ⑤碳碳之间都是单键 |
B | ①饱和链烃,通常情况下是气态 ②有同分异构体 ③二溴代物有三种 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com