
题目列表(包括答案和解析)
 (10分)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列各问题:
(10分)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列各问题:
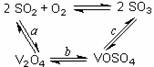 (1)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图)。其中过程a的化学方程式可表示为 ▲ 。
(1)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图)。其中过程a的化学方程式可表示为 ▲ 。
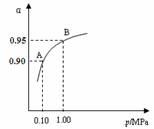 (2)一定温度时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。A与B表示不同压强下的SO2转化率,通常情况下工业生产中
(2)一定温度时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。A与B表示不同压强下的SO2转化率,通常情况下工业生产中
采用常压的原因是 ▲ 。
(3)下列有关硫酸工业生产的说法正确的是(填字母序号) ▲ 。
A.粉碎黄铁矿使其充分燃烧
B.过量空气能提高SO2的转化率
C.吸收塔中使用稀硫酸自上而下逆向吸收SO3
D.沸腾炉排出的矿渣可供炼铁
(4)硫酸工业的尾气与氨水反应所得到的高浓度溶液中,再按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体,析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为 ▲ 。生产中需要向溶液中加入适量的对苯二酚等物质,其作用是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com