
题目列表(包括答案和解析)
科研、生产中常涉及钠、硫及其化合物。
(1)工业上用Na2CO3溶液处理水垢中的CaSO4,反应的离子方程式为___________________;实验室中,Na2S溶液长期放置有硫析出,原因为___________________(用离子方程式表示)。
(2)下图是大型蓄电系统的示意图。左右两侧为电解质储罐,中央为电池,反应原理为: ,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
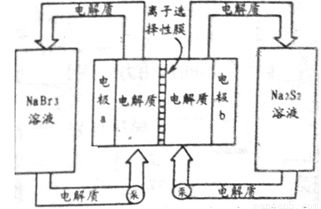
当蓄电池放电时,电池中Na+的移动方向是_________(填“a→b”或“b→a”),电极a的电极反应式为_______________;当蓄电池处于充电状态时,电极b的电极反应式为___________。用该电池做电源,采用惰性电极电解200 mL 1 mol·L-1的AgNO3溶液,当阴极质量增加2.16 g时,电解后溶液的pH为_________(不考虑溶液体积变化)。
(3)工业上,用Na2SO3溶液作为吸收液可吸收烟气中的SO2,吸收SO2过程中,溶液pH与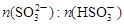 关系如下表:
关系如下表:
|
|
91∶9 |
1∶1 |
9∶91 |
|
pH(25℃) |
8.2 |
7.2 |
6.2 |
①由上表判断,NaHSO3溶液显________性,用平衡原理解释:__________________。
②当溶液呈中性时,溶液中离子浓度的大小关系为_____________________________。
 运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:
运用化学知识解决生产、生活中的有关问题备受关注.请回答下列问题:| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
 (2009?南京二模)工业上可利用合成气(CO和H2的混合气体)生产甲醇(如反应④).已知:
(2009?南京二模)工业上可利用合成气(CO和H2的混合气体)生产甲醇(如反应④).已知:| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 组别 | 原料气中各组分的体积分数 | |||
| CO | CO2 | H2 | N2 | |
| 第1组 | 19.7 | 0.0 | 59.1 | 21.2 |
| 第2组 | 20.7 | 0.3 | 62.1 | 16.9 |
| 第3组 | 16.9 | 1.3 | 50.7 | 31.1 |
| 第4组 | 19.8 | 5.5 | 59.4 | 15.3 |
| 第5组 | 20.3 | 10.9 | 60.9 | 7.9 |
(9分)在一有有色气体参加的可逆反应中,体系的颜色变化往往用来说明平衡的建立或平衡的移动,而对这种颜色变化的观察又受到观察角度及操作过程的不同而有所变化。如图所示,在一定温度、压强下,在透明的玻璃圆筒中装入NO2、N2O4的混合气体100ml,并使可逆反应2NO2 N2O4达到平衡。(注意:视线b是一圆截面,颜色深浅可以看成有色分子在截面上的投影的密度大小)
N2O4达到平衡。(注意:视线b是一圆截面,颜色深浅可以看成有色分子在截面上的投影的密度大小)

(1) 将混合气体突然压缩至50mL则通过视线a方向观察到的平衡体系的颜色变化是____________。而由视线b方向观察到的平衡体系的颜色变化是________________。说明造成从a、b 不同方向观察的颜色变化趋势不同的原因是_________________________________________________________。
(2) 将混合气体缓缓压缩至50mL,则由视线a方向观察到的颜色变化为________________________-。
(3) 上述气体采用上述两种不同的压缩方法,都于相同温度和50mL体积的状态下达到平衡,则此时平衡体系的平均分子量M1和M2的关系为_______________-。气体颜色___________________(填“相同”或“不同”)
(4) 在相同温度、压强下,若容器起初只装入N2O4,达平衡后,重复上述实验,现象是否相同____________。
在NO2 生成N2O4 的可逆反应里,逆反应是 (填吸热、放热)反应:2NO2 (g)  N2O4(g) ,压缩时该平衡体系向环境
(吸收、放出)热量。
N2O4(g) ,压缩时该平衡体系向环境
(吸收、放出)热量。
(9分)工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)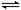 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是 。
A.向装置中充入O2 B.升高温度
C.向装置中充入N2 D.向装置中充入过量的SO2
(2)恒温恒压,通入3mol SO2和2mol O2 及固体催化剂,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g),下列说法正确的是
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
(3)500 ℃时将10 mol SO2和5.0 mol O2置于体积为1L的恒容密闭容器中,SO2转化为SO3的平衡转化率为0.95。则500℃时的平衡常数K= 。
(4)550 ℃,A、B表示不同压强下的平衡转化率(如图),通常工业生产中采用常压的原因是 ,
并比较不同压强下的平衡常数:K(0.10 MPa) K(1.0 MPa)。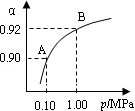
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com