
题目列表(包括答案和解析)
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
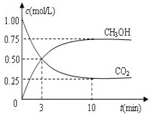 2009年10月15日新华社报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
2009年10月15日新华社报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:| c(CH3OH) | c(CO2) |

(1)写出甲试管中的主要化学反应方程式:___________________________________________。
(2)加入浓硫酸的目的是__________________________________________________________。
(3)试管乙中观察到的现象是______________________________________________________。
(4)在实验中球形管除起冷凝作用外,另一个重要作用是__________________________,其原因是______________________________。
(5)饱和碳酸钠溶液的作用是____________________________。

(1)写出甲试管中的主要化学反应方程式____________________________________________。
(2)加入浓硫酸的目的是____________________________________________________。
(3)试管乙中观察到的现象是_________________________________________________。
(4)在实验中球形干燥管除了起冷凝作用外,另一个重要作用是_________________________,其原理是________________________________________________________________。
(5)饱和碳酸钠溶液的作用是________________________________________________。
(07年全国卷Ⅱ)在盛有稀H2SO4的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SO42-离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com