
题目列表(包括答案和解析)
| ||
| ||

| ||
| ||
(1)摄入过多的淀粉,人为什么容易发胖?摄入过多的油脂,人为什么更容易发胖?
(2)淀粉在酸性条件下发生水解,如何证明淀粉水解完全?
(3)当病人因生病无法进食时,常常注射葡萄糖溶液,请说明其原因。
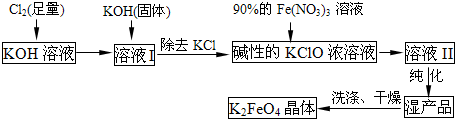
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2 反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式
,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3 、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(12分)为研究温度对Cl2与KOH反应的影响,设计实验如下:
在蒸馏烧瓶中装入足量MnO2,分液漏斗中装足量浓盐酸,大试管A中装4mol/LKOH溶液15mL,并置于75℃水浴中,大试管B中装02mol/LKOH溶液,并置于冰水中,C中装NaOH溶液。
试回答下列问题:
(1)水浴加热有什么优点?
(2)如何判断A中已经反应完全?
(3)分离A中生成的两种盐,检测发现其中KCl为005mol(不考虑HCl挥发),写出A中发生的化学方程式
(4)分离B中生成的两种盐, 其物质的量之比为1:1,写出离子方程式。
其物质的量之比为1:1,写出离子方程式。
(5)试管B要置于冰水中降温的主要原因是:
| A.从试管A中出来的气体温度较高,易使试管B中的溶液温度升高 | |
| B.防止生成的盐分解 | C.催化剂在冷水中活性最强 |
| D.该反应是放热反应,为防止温度过高,采用降温 |
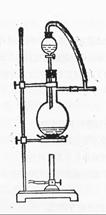
 可以用图二代替吗?。
可以用图二代替吗?。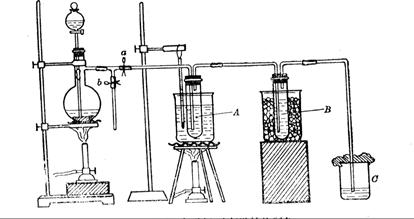
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com