
题目列表(包括答案和解析)
电石(主要成分为CaC2,杂质为CaO和CaS)是工业制乙炔的常见原料,某研究性学习小组拟用以下两种方案测定CaC2的质量分数,试完成下列各题。
方法一:称取1.40 g样品于圆底烧瓶中,用分液漏斗加入适量的水,使样品反应完全,将产生的无色
气体经B洗气后,通过量气装置测得乙炔气体体积为标准状况下448 mL(不考虑乙炔在水中的溶解,
下同)。
(1)电石水解生成乙炔气体的化学方程式为:
(2)用两个装入适当试剂的广口瓶、两个双孔橡胶塞及导管若干,完成上述实验的装置,请在图中将其补充完整,并注明广口瓶中装入试剂的名称。

(3)对获得准确的气体体积无益的操作有 (填序号)
①检查装置的气密性;
②恢复到室温后再上下调整量筒位置,使C、D两液面相平;
③在A装置胶塞上再连接一个导管,通入N2将A中C2H2全部进入到B、C中;
④读数时视线与量筒内凹液面最低点相平
(4)由以上数据可计算出样品中CaC2的质量分数为____ 。
方法二:称取l.40g样品于下图所示石英管中(夹持及加热装置省略),从a处不断缓缓通入空气,高
温灼烧石英管中的样品至反应完全,测得丙溶液的质量比反应前增重了1.80g,反应方程式为:2CaC2+
5O2=2CaO+ 4CO2。

(5)反应完成后,石英管内样品易与管壁产生腐蚀,试用化学方程式解释其原因
(6)甲锥形瓶中酸性高锰酸钾溶液的作用为
(7)由此方法测得的样品中CaC2的质量分数比方法一中的____ (填“大”、“小”或“相
等”),从实验装置的角度看,原因为 。
电石(主要成分为CaC2,杂质为CaO和CaS)是工业制乙炔的常见原料,某研究性学习小组拟用以下两种方案测定CaC2的质量分数,试完成下列各题。
方法一:称取1.40 g样品于圆底烧瓶中,用分液漏斗加入适量的水,使样品反应完全,将产生的无色
气体经B洗气后,通过量气装置测得乙炔气体体积为标准状况下448 mL(不考虑乙炔在水中的溶解,
下同)。
(1)电石水解生成乙炔气体的化学方程式为:
(2)用两个装入适当试剂的广口瓶、两个双孔橡胶塞及导管若干,完成上述实验的装置,请在图中将其补充完整,并注明广口瓶中装入试剂的名称。
(3)对获得准确的气体体积无益的操作有 (填序号)
①检查装置的气密性;
②恢复到室温后再上下调整量筒位置,使C、D两液面相平;
③在A装置胶塞上再连接一个导管,通入N2将A中C2H2全部进入到B、C中;
④读数时视线与量筒内凹液面最低点相平
(4)由以上数据可计算出样品中CaC2的质量分数为____ 。
方法二:称取l.40g样品于下图所示石英管中(夹持及加热装置省略),从a处不断缓缓通入空气,高
温灼烧石英管中的样品至反应完全,测得丙溶液的质量比反应前增重了1.80g,反应方程式为:2CaC2+
5O2=2CaO+ 4CO2。
(5)反应完成后,石英管内样品易与管壁产生腐蚀,试用化学方程式解释其原因
(6)甲锥形瓶中酸性高锰酸钾溶液的作用为
(7)由此方法测得的样品中CaC2的质量分数比方法一中的____ (填“大”、“小”或“相
等”),从实验装置的角度看,原因为 。


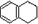 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下: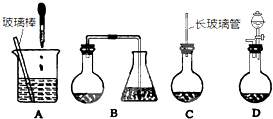
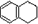 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
| △ |
| △ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com