
题目列表(包括答案和解析)
Ⅰ.课本中通过向草酸(H2C2O4)溶液中滴加用硫酸酸化高锰酸钾中研究浓度对化学反应速率的影响,请你写出该反应的化学方程式 ,该反应不需使用指示剂的原因是 ;
Ⅱ.某同学根据课本外界条件对化学反应速率的影响原理,设计了硫代硫酸钠与硫酸反应有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
实验
序号 反应温度
(℃) 参加反应的物质
Na2S2O3 H2SO4 H2O
V/mL c/mol•L-1 V/mL c/mol•L-1 V/mL
A 20 10 0.1 10 0.1 0
B 20 5 0.1 10 0.1 5
C 20 10 0.1 5 0.1 5
D 40 5 0.1 10 0.1 5
(1)写出上述反应的离子方程式
(2)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是 (填实验序号)
(3)在利用比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有 关的各项反应条件.其中:
①能说明温度对该反应速率影响的组合比较是 ;(填实验序号)
②A和B、A和C的组合比较所研究的问题是
③B和C的组合比较所研究的问题是
(4)教材是利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小的可能原因:
Ⅰ.课本中通过向草酸(H2C2O4)溶液中滴加用硫酸酸化高锰酸钾中研究浓度对化学反应速率的影响,请你写出该反应的化学方程式 ,该反应不需使用指示剂的原因是 ;
Ⅱ.某同学根据课本外界条件对化学反应速率的影响原理,设计了硫代硫酸钠与硫酸反应有关实验,实验过程的数据记录如下(见表格),请结合表中信息,回答有关问题:
| 实验 序号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol?L-1 | V/mL | c/mol?L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
| 实验 序号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol?L-1 | V/mL | c/mol?L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
完成下列各题
(1)将一定量镁粉逐渐投入饱和FeCl3的黄色溶液中,首先看到溶液变成红褐色,并产生气
泡;后来有少量的红褐色沉淀生成。请回答下列问题:
①红褐色溶液是 ,气泡的成分是 。
②用简洁的文字和反应方程式解释该实验的现象
(2)已知KSP(Fe(0H)3)==1.25×10-38,KSP(Mg(OH)3)=1.8×10-11,当溶液中某离子的浓度小于1×10-5mol.L-1时,可认为该离子已沉淀完全。又知:lg2=0.3,lg5=0.7,则在Fe3+和Mg2+的浓度均为0.1 mol.L-1的溶液中:
①什么沉淀也不生成的最大pH应控制为 ;
②已知:pH=-4时,c(Fe 3+)小于1![]() mol.L-1,通过数据分析说明,控制溶液的pH是否可将Fe3+和Mg2+完全分 离 。
mol.L-1,通过数据分析说明,控制溶液的pH是否可将Fe3+和Mg2+完全分 离 。
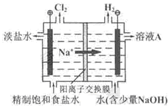 (2011?北京)氯碱工业中电解饱和食盐水的原理示意图如右图所示.
(2011?北京)氯碱工业中电解饱和食盐水的原理示意图如右图所示.
| ||
| ||
 HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出 HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出
HCl+HClO,增大HCl的浓度使平衡逆向移动.减少Cl2在水中的溶解,有利于Cl2的逸出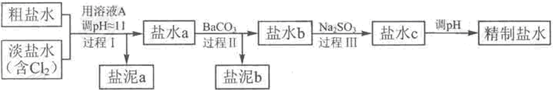
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com