
题目列表(包括答案和解析)
有铝和四氧化三铁组成的铝热剂粉末,在隔绝空气中的条件下引燃,使之充分反应,把所得混合物研细,并分成两等份,分别投入到过量烧碱溶液和盐酸中,充分反应后,前者消耗氢氧化钠mmol,放出标准状况下的气体0.672L;后者消耗盐酸nmol,放出标准状况下气体VL。若将等质量的这种铝热剂中的铝粉和足量的稀硫酸反应,可以得到标准状况下的气体6.72L。
(1)铝热剂中各成分的质量分数。
(2)m、n、V的值各是多少?
镁、铝、铁及其化合物在生产和生活中有广泛的应用.
1.镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2 mol/L稀硫酸中生成0.2 mol氢气,计算并确定镁铝合金中物质的量n(Mg)∶n(Al)=________.
2.硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料.取某硫铁矿10 g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4 g(杂质SiO2不反应).该硫铁矿中FeS2的质量分数为________.
3.现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是________.

4.炼铁厂生产的生铁常用于炼钢.取某钢样粉末28.12 g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224 mL(标准状况下).
(1)计算此钢样粉末中铁和碳的物质的量之比为________(最简单的整数比).
(2)再取三份不同质量的上述钢样粉末分别加到100 mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如下表所示:
则该硫酸溶液的物质的量浓度为________.
(3)若在上述实验Ⅱ中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为________g.(保留3位小数)
目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。

请回答下列的问题。
铁在周期表中的位置是_______
请写出该反应的化学方程式: ;
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
|
|
① |
② |
③ |
④ |
|
溶液中的金属离子 |
|
Fe2+ |
|
|
|
残留固体成分 |
Fe、Pt |
|
Pt |
Pt |
②当x=0.5 ,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mLNO。
则a = ,b = ,
目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。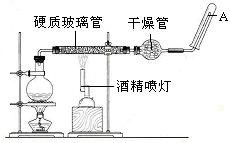
请回答下列的问题。
铁在周期表中的位置是_______
请写出该反应的化学方程式: ;
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
| | ① | ② | ③ | ④ |
| 溶液中的金属离子 | | Fe2+ | | |
| 残留固体成分 | Fe、Pt | | Pt | Pt |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com